Nội dung bài viết
Khí H2S được cảnh báo là độc hại khi tiếp xúc. Vậy đó là khí gì? Làm thế nào để xác định các đặc tính vật lý và hóa học? Hãy cùng nhau tìm hiểu qua bài viết dưới đây nhé!
1. Khí H2S là gì? Cấu trúc của khí H2S?
Khí H2S (gọi là hydrogen sulfide) là một trong những hợp chất hóa học có đặc điểm rất dễ nhận biết.
H2S có cấu trúc tương tự như phân tử nước, H2S là sự kết hợp của 2 nguyên tử H và một nguyên tử S. Trong đó S là hạt trung tâm và chứa 2 hydrogen đơn độc liên kết với nhau bằng một liên kết đơn.
Tuy nhiên, lưu huỳnh không có độ âm điện như oxy nên H2S không có cực như nước. Vì vậy, trong H2S tồn tại lực liên phân tử tương đối yếu và nhiệt độ sôi, nóng chảy thấp hơn nhiều so với trong nước.
H2S được hình thành phổ biến nhất do sự phân hủy chất hữu cơ của vi sinh vật trong điều kiện không có oxy (phân hủy kỵ khí). Khí hydro sunfua cũng được tìm thấy trong khí núi lửa, dầu thô, khí tự nhiên và một số giếng hoặc suối nước nóng. Điều thú vị là cơ thể con người cũng sản xuất ra một lượng nhỏ H2S được sử dụng tiếp làm phân tử truyền tín hiệu.
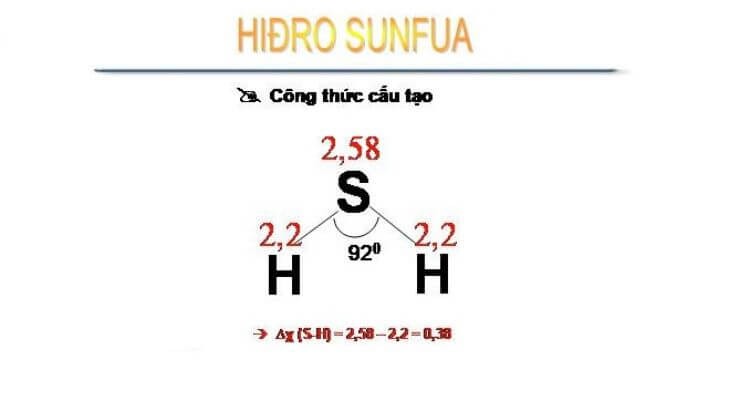
Cấu trúc của khí H2S
2. Tính chất lý hóa của khí H2S
Khí H2S có các tính chất sau:
2.1. Tính chất vật lý
Tính chất vật lý điển hình của khí H2S như sau:
- Nó có mùi trứng thối rất đặc trưng.
- Là một loại khí dễ cháy.
- Điểm sôi của nước và hydro sunfua lần lượt là 100 độ C và – 60 độ C.
- Nó là chất khí đặc hơn và nặng hơn không khí một chút nhưng hòa tan tốt trong nước và dung môi hữu cơ.
- Đây là một loại khí độc, không màu, có thể gây đau đầu ngay cả khi hít phải một lượng nhỏ.
- Ở áp suất trên 90 GPa, H2S trở thành chất dẫn kim loại.
2.2. Tính chất hóa học
– Tính axit yếu:
- Có tính axit nên giấy quỳ xanh chuyển sang màu đỏ.
- H2S có khả năng phản ứng với dung dịch kiềm tạo thành muối trung tính và nước.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + H2O
- H2S phản ứng với dung dịch muối cacbonat tạo thành muối trung tính và nước.
H2S + Na2CO3 → NaHCO3 + NaHS
– Tính khử mạnh: H2S đóng vai trò là chất khử và chủ yếu khi có mặt bazơ sẽ tạo ra SH-
- Hỗn hợp không khí và H2S có thể gây nổ theo phản ứng sau:
2H2S+ 3O2 → 2H2O + 2SO2
- H2S phản ứng với kim loại tạo thành muối sunfua kim loại không hòa tan và thường là chất rắn màu tối:
2H2S + 2K → 2KHS + H2
- H2S phản ứng với Ag tạo thành muối sunfit:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
- H2S bị oxy hóa khi phản ứng với clo tạo thành H2SO4 khi có mặt nước:
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
3. Điều chế khí H2S như thế nào?
Tùy theo điều kiện, khí H2S có thể được điều chế bằng nhiều cách khác nhau như sau:
3.1. Trong phòng thí nghiệm
H2S được tạo ra bằng cách cho sắt sunfua phản ứng với axit mạnh trong bình Kipp:
FeS + 2 HCl → FeCl2 + H2S
Hoặc những cách khác như:
– Sunfua kim loại và phi kim tiếp xúc với nước: 6 H2O + Al2S3 → 3 HS + 2Al(OH)3.
– Phân tích Thioacetamide: CH3C(S)NH2 + H2O → CH2C(O)NH2 + H2S.
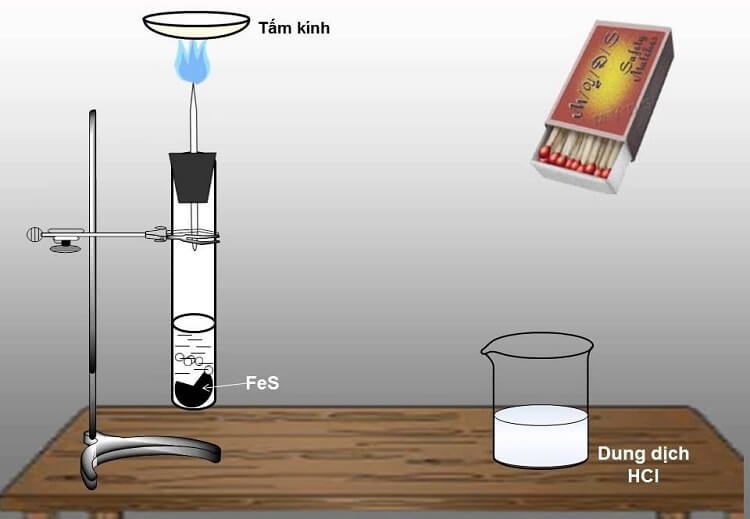
Điều chế khí H2S trong phòng thí nghiệm
3.2. Trong công nghiệp
Phương pháp phổ biến nhất để sản xuất hydrogen sulfide là tách nó ra khỏi “khí chua” – một loại khí tự nhiên có hàm lượng H2S cao.
Ngoài ra còn được chế biến theo những cách khác như:
- Dùng nguyên tố S nóng chảy phản ứng với H2 ở nhiệt độ khoảng 450 độ C.
- Vi khuẩn khử sunfat oxy hóa các hợp chất hữu cơ hoặc H2 trong điều kiện oxy thấp.
4. Khí H2S có độc không?
Khí H2S là khí độc vì nhiều lý do dưới đây:
- Nó là một loại khí dễ nổ, có khả năng gây ra các tình trạng nguy hiểm đến tính mạng nếu xử lý không cẩn thận. Ngoài ra, nó dễ cháy và tạo thành các loại khí và hơi độc khác như SO2.
- Nếu chúng ta tiếp xúc với nồng độ H2S thấp, nó có thể gây ra một số triệu chứng như: kích ứng mũi, họng, mắt, buồn nôn, khó thở, nhức đầu, giảm trí nhớ, mệt mỏi và các vấn đề khác. Vấn đề cân bằng cơ thể. Một số người có thể cảm thấy khó thở, đặc biệt là những người mắc các bệnh như hen suyễn.
- Tiếp xúc ngắn hạn với nồng độ H2S cao (thường lớn hơn 1000 ppm) có thể gây bất tỉnh, nhiều người dẫn đến tổn thương vĩnh viễn hoặc lâu dài như đau đầu, giảm khả năng tập trung, chóng mặt, trí nhớ kém. và chức năng vận động.
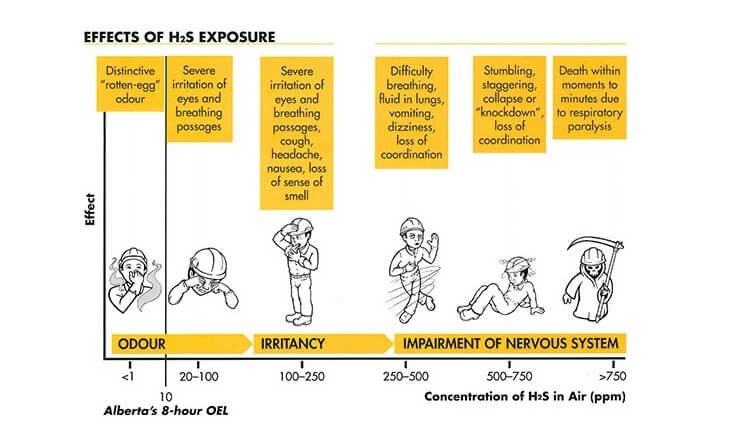
Triệu chứng ngộ độc khí H2S
5. Ứng dụng của khí H2S trong đời sống
H2S được ứng dụng trong nhiều ngành công nghiệp khác nhau như sau:
- Trong nghiên cứu hóa phân tích dùng để phát hiện cation.
- H2S là tiền thân của lưu huỳnh nguyên tố. Vì vậy nguyên tố S, H2SO4 và một số hợp chất lưu huỳnh hữu cơ như metanthiol, ethanethiol, axit thioglycolic được sử dụng…
- Để điều chế sunfua kim loại, nhiều chất trong số đó được sử dụng trong ngành sơn.
- Để tách oxit deuterium hoặc nước nặng khỏi nước bình thường thông qua quy trình Girdler sulfide.
- Trong nông nghiệp, H2S được sử dụng làm chất khử trùng.
- Trong lĩnh vực y tế, việc cho tế bào tiếp xúc với một lượng nhỏ khí H2S giúp ngăn ngừa tổn thương ty thể.
- Trong gia công kim loại và gia công: H2S là thành phần trong một số loại dầu cắt gọt, chất làm mát và chất bôi trơn.
Trên đây là những thông tin cơ bản về khí H2S. Nếu có thắc mắc, bạn có thể liên hệ với chúng tôi tại thanh chat cuối màn hình hoặc tham khảo thêm các bài viết trên vietchem.com.vn.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn