Nội dung bài viết
Oxit cơ bản là gì? Nó có những đặc tính điển hình nào và nó được sử dụng như thế nào? Để hiểu rõ hơn về các oxit bazơ, mời các bạn cùng Meraki Center tham khảo bài viết dưới đây.
1. Định nghĩa oxit bazơ là gì?
Khái niệm oxit bazơ được hiểu một cách đơn giản nhất là sự kết hợp của một kim loại với các nguyên tử oxy và kim loại.
Ví dụ: Na2O, K2O, BaO…
Công thức oxit cơ bản bao gồm một hoặc nhiều nguyên tử kim loại (M) và một hoặc nhiều nguyên tử oxy. Tùy thuộc vào hóa trị của kim loại mà có công thức phù hợp như kim loại hóa trị một cần 2 nguyên tử kim loại để tạo thành oxit bazơ. Kim loại hóa trị hai chỉ cần 1 nguyên tử oxy.

Một số oxit bazơ
2. Phân loại oxit bazơ
Tùy thuộc vào đặc điểm cụ thể của kim loại trong phân tử, người ta phân thành các loại sau:
- Oxit bazơ hòa tan: Bao gồm các chất kiềm như Na, K, Li… và các chất kiềm thổ như Na, Sr, Cs, Li, Ba,…
- Oxit bazơ không tan: Gồm các oxit của các kim loại còn lại như Fe, Cu,…
Ngoài ra, dựa trên tính chất của nó, nó còn được chia thành các oxit lưỡng tính và trung tính:
- Oxit lưỡng tính: Đây là những oxit phản ứng với dung dịch axit và phản ứng với dung dịch bazơ tạo thành muối và nước. Điển hình là Al2O3, ZnO…
- Oxit trung tính: Oxit không phản ứng với nước tạo thành axit hoặc bazơ và không phản ứng với axit hoặc bazơ để tạo thành muối. Ví dụ KHÔNG, CO…
3. Tính chất hóa học điển hình của oxit bazơ
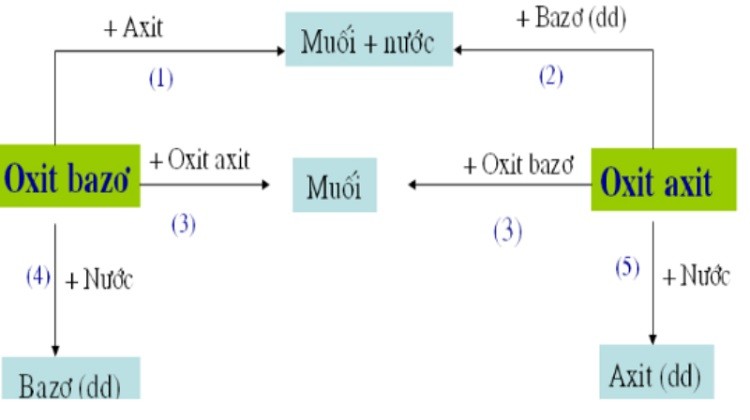
Oxit bazơ phản ứng với nước, oxit axit, axit cụ thể là:
– Tác dụng với H2O:
Chỉ các oxit bazơ của kim loại kiềm và kim loại kiềm phổ thông mới phản ứng với nước. Vì vậy, chúng tan trong nước gồm: Na2O, CaO, BaO, K2O,… tạo thành các bazơ hòa tan (kiềm) lần lượt là NaOH, Ca(OH)2, Ba(OH)2, KOH.
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
Sản phẩm thu được sau phản ứng là NaOH, KOH,… làm giấy quỳ tím đổi màu.
– Phản ứng với axit
Hầu hết các oxit bazơ đều phản ứng với axit tạo thành muối và nước. Công thức tổng quát được biểu diễn như sau: Oxit bazơ + Axit → Muối + H2O.
Na2O + H2SO4 → Na2SO4 + H2O
CuO + 2HCl → CuCl2 + H2O
– Phản ứng với oxit axit
Một số oxit bazơ còn phản ứng với oxit axit tạo thành muối. Thông thường đây là những oxit bazơ phản ứng với nước như oxit kiềm, tạo ra muối tan trong nước. Nó cũng phản ứng với nước để tạo ra muối không hòa tan, thường là oxit kiềm thổ.
Công thức như sau: Oxit bazơ + Oxit axit → Muối.
Cụ thể:
Na2O + CO2 → Na2CO3
BaO + CO2 → BaCO3↓
Tính chất hóa học của oxit cơ bản
4. Ứng dụng của oxit bazơ trong đời sống
Oxit bazơ có vai trò rất quan trọng và được ứng dụng rộng rãi trong đời sống từ xử lý nước bể bơi, sản xuất thuốc, xử lý vải thô,… Cụ thể:
- Công nghiệp hóa chất và dược phẩm: Được sử dụng để sản xuất các sản phẩm có gốc natri và làm chất tẩy trắng hoặc khử trùng.
- Trong phòng thí nghiệm: Là chất hóa học quan trọng phục vụ cho học tập và nghiên cứu.
- Trong công nghiệp thực phẩm: Chuẩn bị dung dịch kiềm, xử lý rau quả trước khi chế biến hoặc đóng hộp.
- Ứng dụng trong ngành dệt nhuộm: Phân hủy pectin và sáp để xử lý vải thô, giúp vải dễ dàng hấp thụ thuốc nhuộm và có màu sắc đẹp nhất.
- Xử lý nước, đặc biệt là nước bể bơi: Các oxit bazơ hòa tan trong nước làm tăng độ pH. Ngoài ra, oxit bazơ còn được dùng để trung hòa, loại bỏ chất bẩn trong đường ống nước sinh hoạt.
- Ứng dụng trong ngành dầu khí: Bazơ cân bằng PH cho dung dịch khoan, loại bỏ lưu huỳnh, hợp chất lưu huỳnh hoặc hợp chất axit trong lọc dầu.
- Trong nghiên cứu hiện đại, hạt nano oxit kim loại có nhiều ứng dụng như vi điện tử, năng lượng, lưu trữ, khử nhiễm môi trường, cảm biến khí, sản xuất gốm sứ, y sinh…
Ứng dụng của canxi oxit
Ngoài ra, một số oxit quan trọng được ứng dụng trong đời sống như:
- Magiê oxit (MgO) – là chất dẫn nhiệt và cách điện tốt được sử dụng trong vật liệu chịu lửa và cách nhiệt.
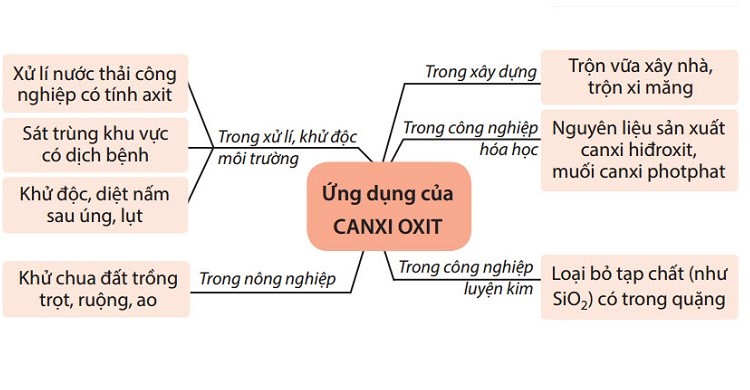
- Một oxit khác là canxi oxit (CaO), còn gọi là vôi sống, được sử dụng rộng rãi trong ngành thép và trong lọc nước.
- Oxit sắt phổ biến và được sử dụng rộng rãi vì chúng rẻ tiền và đóng vai trò quan trọng trong nhiều quá trình sinh học và địa chất. Con người sử dụng oxit sắt rộng rãi như quặng sắt trong thermite, chất xúc tác, chất màu vĩnh viễn (lớp phủ, sơn và bê tông màu) và huyết sắc tố.
Trên đây là những thông tin cơ bản về oxit sắt. Nếu có thắc mắc, bạn có thể liên hệ với chúng tôi tại thanh chat cuối màn hình hoặc tham khảo thêm các bài viết trên vietchem.com.vn.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn