Công thức tính bài toán nhiệt nhôm hay nhất – Hóa học lớp 12 – Tóm tắt công thức Hóa học lớp 12 quan trọng đầy đủ, chi tiết giúp học sinh dễ dàng nhớ được công thức Hóa 12.-Công thức tính bài toán nhiệt nhôm hay nhất – Hóa học lớp 12
Công thức tính bài toán nhiệt nhôm hay nhất – Hóa học lớp 12
Bài viết Công thức tính bài toán nhiệt nhôm hay nhất, chi tiết với bài tập minh họa có lời giải
sẽ giúp học sinh nắm vững Công thức tính bài toán nhiệt nhôm từ đó biết cách làm bài tập về tính bài toán nhiệt nhôm.
Công thức tính bài toán nhiệt nhôm hay nhất
Các em thân mến, bài toán nhiệt nhôm là một dạng toán thường xuất hiện trong các đề thi. Tuy nhiên, không phải bạn nào cũng làm đúng. Bài viết dưới đây, sẽ cho các em một cái nhìn tổng quan về dạng bài phản ứng nhiệt nhôm. Từ đó, giúp các em làm tốt các bài tập dạng này.
1. Công thức tính bài toán nhiệt nhôm
– Phản ứng nhiệt nhôm là phản ứng của nhôm tác dụng với các oxit kim loại ở nhiệt độ cao.
(Hỗn hợp X) Al + oxit kim loại → (Hỗn hợp Y) oxit nhôm + kim loại
– Các trường hợp của phản ứng nhiệt nhôm:
+ Trường hợp 1: Hiệu suất phản ứng đạt 100%
→ Phản ứng xảy ra hoàn toàn.
+ Trường hợp 2: Hiệu suất phản ứng < 100%.
→ Phản ứng xảy ra không hoàn toàn. Một phần lượng oxit đã chuyển hóa thành kim loại.
– Phương pháp giải:
+ Tính toán theo phương trình.
+ Áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố và bảo toàn electron:
Bảo toàn khối lượng: 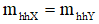
Bảo toàn nguyên tố: 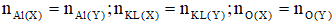
Bảo toàn electron: 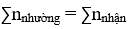
2. Bạn nên biết
– Nhiệt lượng do phản ứng nhiệt nhôm tỏa ra rất lớn làm nóng chảy kim loại.
3. Mở rộng
– Đa phần các bài toán về nhiệt nhôm có dạng: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm nhôm và oxit sắt.
– Phương trình tổng quát:
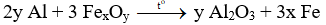
– Chú ý: nếu hỗn hợp sau phản ứng cho tác dụng với dung dịch kiềm thấy có khí thoát ra → Al dư.
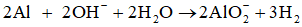
4. Bài tập minh họa
Câu 1: Tiến hành nhiệt nhôm hỗn hợp X gồm 0,12 mol Al và 0,04 mol Fe3O4 (không có không khí) một thời gian thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl thấy sau khi phản ứng xong thu được 0,135 mol khí H2 và còn m gam chất rắn là Fe chưa tan hết. Giá trị của m là
A. 0,28.
B. 3,36.
C. 1,40.
D. 0,70.
Hướng dẫn giải
Qui đổi hỗn hợp X thành:

Gọi nFe chưa tan sau phản ứng = x mol
Áp dụng định luật bảo toàn electron ta có:
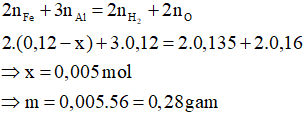
Đáp án A
Câu 2: Dùng m gam Al để khử hoàn toàn một lượng Fe2O3 sau phản ứng thấy khối lượng oxit giảm 0,58 g. Khối lượng nhôm đã dùng là:
A. 0,27 gam
B. 2,7 gam
C. 0,54 gam
D. 1,12 gam
Hướng dẫn giải
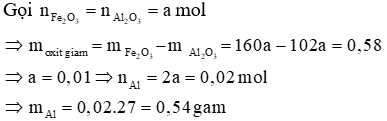
Đáp án C

Câu 3: Trộn 6,48 gam Al với 16 gam Fe2O3. Thực hiện phản ứng nhiệt nhôm được chất rắn A. Khi cho A tác dụng với dung dịch NaOH dư, có 1,344 lít H2 (đktc) thoát ra. Tính hiệu suất phản ứng nhiệt nhôm (hiệu suất được tính đối với chất thiếu).
A. 100%
B. 85%
C. 80%
D. 75%
Hướng dẫn giải
Ta có: 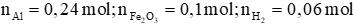
Phương trình phản ứng nhiệt nhôm
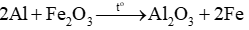
Nhận thấy: 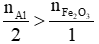 → Hiệu suất tính theo Fe2O3.
→ Hiệu suất tính theo Fe2O3.
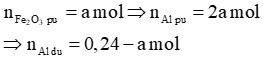
Chất rắn A tác dụng với NaOH
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Bảo toàn electron ta có:
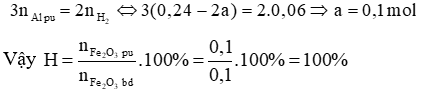
Đáp án A
Xem thêm các Công thức Hóa học lớp 12 quan trọng hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn