Nội dung bài viết
Thuật ngữ Rễ axit rất quen thuộc trong hóa học cũng như trong các lĩnh vực nghiên cứu hóa sinh. Để độc giả hiểu rõ hơn về gốc Acid là gì cũng như ứng dụng của chúng trong cuộc sống, Meraki Center sẽ tổng hợp những kiến thức sơ bộ về gốc Acid trong bài viết sau nhé!
1. Rễ axit là gì?
Axit được cấu tạo từ các nguyên tử Hydro và các gốc Axit theo tỷ lệ tùy thuộc vào hóa trị của gốc Axit. Như vậy, gốc Axit là một phần của phân tử Axit sau khi nguyên tử Hydro được tách ra.
Sự tồn tại của gốc Acid có thể được tìm thấy trong nhiều môi trường khác nhau. Từ môi trường thí nghiệm với axit tinh khiết đến môi trường sống hàng ngày của con người như thực phẩm, đồ uống,…
Theo các chuyên gia, sự hiện diện của gốc axit trong nước, rượu, đồ uống có ga, thực phẩm béo… không tốt cho sức khỏe. Nếu sử dụng lâu dài nguy cơ mắc nhiều bệnh là không thể tránh khỏi.
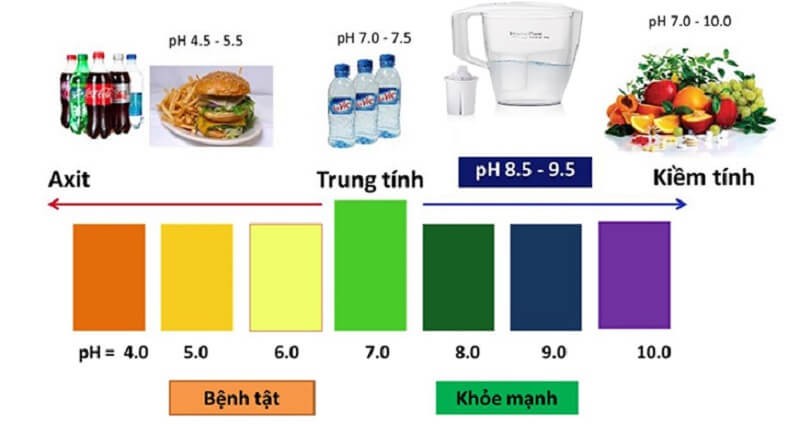
Hình 1: Gốc axit không tốt cho sức khỏe nếu tồn tại trong thực phẩm
2. Có những loại axit nào?
Việc phân loại gốc Acid góp phần giúp cho việc nghiên cứu tính chất hóa học cũng như ứng dụng của nhóm gốc Acid trở nên thuận tiện hơn.
2.1. Phân loại gốc axit theo cấu trúc
Dựa vào cấu trúc, gốc axit có thể được chia thành hai loại:
- Các gốc axit chứa Hydro: -HSO4, =HPO4, -H2PO4
- Các gốc axit không chứa hydro: ☰PO4, – Cl, -NO3, =SO4
2.2. Phân loại theo nguyên tố Oxi trong gốc Axit
Dựa vào sự tồn tại của nguyên tố Oxy trong gốc Axit, chúng ta có thể chia gốc Axit thành hai loại:
- Axit bazơ với oxy: -NO3, =SO4, ☰PO4
- Các gốc axit không có oxy: Cl, -Br, -F, -I
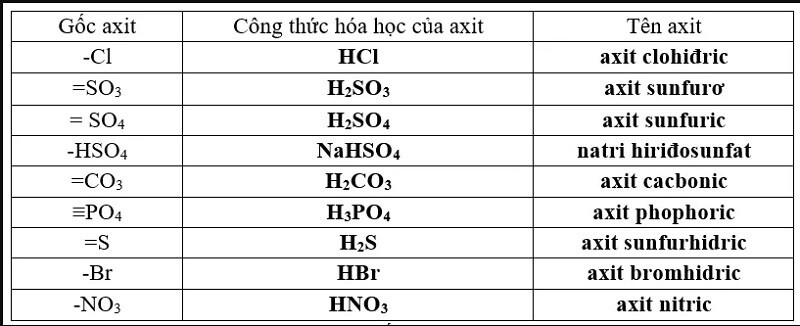
Hình 2: Các gốc axit được phân loại theo cấu trúc và nguyên tố oxy trong axit
3. Tính chất hóa học của gốc axit là gì?
Để hiểu axit bazơ là gì, bạn cần hiểu tính chất hóa học cơ bản của axit, đó là làm đổi màu quỳ xanh thành đỏ. Đồng thời, nó có thể phản ứng với nhiều kim loại, bazơ, oxit bazơ và muối để tạo thành hợp chất, chất mới.
3.1. Phản ứng với bazơ
Các gốc axit phản ứng với bazơ tạo thành muối và nước. Phản ứng này còn được gọi là phản ứng trung hòa.
Công thức chung: Axit + Bazơ → Muối + H2O
Ví dụ: Ba(OH)2 + 2HCl → BaCl2+ 2H2O

Hình 3: Gốc axit tác dụng với bazơ tạo thành muối và nước
3.2. Phản ứng với các oxit bazơ
Các gốc axit phản ứng với các oxit cơ bản để tạo ra muối và nước.
Công thức chung: Axit + Bazơ → Muối + H2O
Ví dụ:
CuO + 2HCl → CuCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
3.3. Phản ứng với kim loại
Gốc Axit loãng phản ứng với kim loại đứng cạnh Hydro trong bảng tuần hoàn để tạo thành muối và giải phóng Hydro.
Công thức chung: Axit + Kim loại → Muối + H2
Ví dụ: 2Na + 2HCl → 2NaCl + H2
3.4. Tương tác với muối
Các gốc axit phản ứng với muối, tạo ra sản phẩm là chất kết tủa hoặc khí dễ bay hơi tùy thuộc vào độ mạnh của gốc axit. Trường hợp thu được kết tủa (muối không tan) thì gốc axit tham gia phản ứng là gốc axit mạnh. Trường hợp sản phẩm thu được là chất khí dễ bay hơi và muối hòa tan thì axit bazơ ban đầu là axit yếu.
Ví dụ:
K2CO3 + 2HCl → 2KCl + H2O + CO2 (khí) (H2CO3 phân hủy thành H2O và CO2)
H2SO4+ BaCl2 → BaSO4 (rắn) + 2HCl

Hình 4: Gốc axit phản ứng với muối tạo ra khí dễ bay hơi
4. Ứng dụng của một số loại axit bazơ
Hiểu được rễ Acid là gì sẽ giúp chúng ta thấy được sự tham gia của Acid vào nhiều lĩnh vực khác nhau. Nó đóng một vai trò không thể thay thế trong nhiều hoạt động của con người.
4.1. Trong công nghiệp
Sự phát triển đa dạng của ngành công nghiệp phụ thuộc phần lớn vào hóa chất gốc axit. Bao gồm:
- Nhờ đặc tính ăn mòn nên Acid được dùng để làm sạch rỉ sét và làm chất tẩy rửa bề mặt trước khi hàn.
- Là chất điện phân trong ắc quy và ắc quy ô tô.
- Dùng để điều chế các hợp chất quan trọng khác như muối, dầu mỏ, axit.
- Được sử dụng trong ngành luyện kim và chuẩn bị thuốc nổ.
- Dùng để sản xuất nhựa công nghiệp.
- Là chất tẩy trắng cho nhiều loại vật liệu khác nhau.
- Sản xuất phân bón…

Hình 5: Axit bazơ dùng để sản xuất nhựa công nghiệp
4.2. Trong ngành thực phẩm
Sự hiện diện của các gốc axit trong lĩnh vực thực phẩm được thể hiện ở các khía cạnh sau:
- Chất tạo màu, chất bảo quản màu.
- Chất chống tạo bọt.
- Chất chống đóng bánh.
- Chất điều chỉnh độ axit và tăng hương vị.
- Chất chống oxy hóa.
- Chất ổn định.
- Chất nhũ hóa, xử lý hạt.
4.3. Trong ngành y tế và dược phẩm
Trong lĩnh vực y dược, Acid góp phần tạo nên những bước đột phá nhất định cho sự phát triển của ngành. Ví dụ, aspirin, một loại thuốc hạ sốt gốc axit, đã được nghiên cứu, sử dụng và cho thấy có hiệu quả từ cuối thế kỷ 19.
4.4. Trong sinh học
Đối với cơ thể con người, đặc biệt là hệ tiêu hóa, gốc axit có vai trò vô cùng quan trọng. Đó là:
- Phá vỡ cấu trúc phức tạp của phân tử thức ăn, tổng hợp các protein cần thiết cho cơ thể, góp phần duy trì và mang lại sự sống cho con người.
- Axit nucleic tham gia tích cực vào quá trình sản xuất DNA và RNA cũng như quá trình chuyển gen cho thế hệ tiếp theo.
- Axit Carbon giúp duy trì và cân bằng độ PH của cơ thể.
5. Cẩn thận với axit
Để giúp hiểu được Acid Radical là gì, chúng ta cần biết rằng Acid Radical tồn tại trong thế giới con người với hai mặt song song, giúp ích. Bởi bên cạnh những lợi ích, Acid còn có thể gây ra những tác hại không nhỏ cho con người nếu không biết cách tiếp cận và sử dụng đúng cách.
Vì vậy, khi sử dụng Acid cần tuân thủ những quy tắc an toàn sau:
- Đeo găng tay, khẩu trang, kính và thiết bị bảo hộ khi tiếp xúc.
- Không sử dụng dụng cụ bằng kim loại để đựng Axit. Luôn đậy kín nắp và để hóa chất ở nơi khô ráo.
- Không trộn axit với các hóa chất khác để tránh cháy nổ.
Meraki Center vừa chia sẻ đến các bạn một số kiến thức sơ bộ về gốc axit là gì cũng như các loại gốc axit và ứng dụng của chúng trong cuộc sống. Nếu có thắc mắc về Gốc Axit hay các hóa chất khác vui lòng liên hệ Meraki Center quaHotline: 0826 010 010 để được giải đáp cụ thể.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn