Nội dung bài viết
Tính chất hóa học của HCl là gì? Nó có hòa tan trong nước không? Quỳ xanh có đổi màu không? Đó là chất điện ly mạnh hay yếu? HCl tác dụng với những chất nào? Đây là những câu hỏi Vũ Hoàng nhận được rất nhiều liên quan đến chủ đề Axit Clohydric. Bài viết này là câu trả lời đầy đủ nhất cho câu hỏi của bạn. Hãy cùng Vũ Hoàng tìm hiểu chi tiết về tính chất hóa học của HCl nhé.
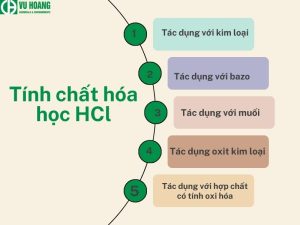 Tính chất hóa học của HCl
Tính chất hóa học của HCl
Tính chất hóa học của HCl
Axit clohydric là một axit vô cơ mạnh, được tạo ra từ sự hòa tan trong nước của khí hydro clorua (HCl). Do đó, nó có tất cả các tính chất hóa học của một axit mạnh. Cụ thể như sau:
- Làm đổi màu quỳ tím
- Là chất điện li mạnh
- Hiệu quả với kim loại, muối, bazơ, oxit kim loại và các chất có tính oxy hóa cao
Mời bạn tham khảo chi tiết từng tính chất của loại axit này.
Tính chất hóa học của HCl làm quỳ tím chuyển sang màu gì?
Vì là axit mạnh nên HCl làm quỳ tím chuyển sang màu đỏ khi tiếp xúc. Đây cũng là đặc điểm nhận dạng rõ ràng nhất của hầu hết các axit mạnh.
Tuy nhiên, xin lưu ý rằng hợp chất này chỉ làm quỳ tím đổi màu khi tồn tại ở dạng dung dịch. Nếu nó tồn tại ở dạng khí thì nó sẽ không làm quỳ tím chuyển sang màu đỏ.
Tính chất hóa học của HCl là chất điện li mạnh
HCl có thể hòa tan hoàn toàn trong nước và phân ly thành ion H+ và ion Cl−. Trong quá trình hòa tan trong nước, ion H+ liên kết với H2O tạo thành ion H3O+. phương trình:
- HCl + H2O → H3O+ + Cl–
HCL tác dụng được với những chất nào?
Phản ứng với kim loại
Các kim loại đứng trước Hydro trong bảng tuần hoàn sẽ phản ứng với HCl, tạo ra muối clorua và giải phóng khí H.
- 2HCl + Mg → MgCl2 + H2
- Fe + 2HCl → FeCl2 + H2
Phản ứng với oxit kim loại
Phản ứng với một số oxit kim loại như CuO, Al2O3, Fe3O4 tạo thành muối và nước
- Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
- 6HCl + Al2O3 → 2AlCl3 + 3H2O
- 2HCl + CuO → CuCl2 + H2O
Tương tác với muối
Axit clohydric phản ứng với muối tạo ra muối mới và axit mới. Điều kiện phản ứng: axit tạo thành phải yếu hơn HCl, sản phẩm kết tủa hoặc tạo thành khí bay lên
- CaCO3 + 2HCl → CaCl2 + H2O + CO2
- 2HCl + BaS → BaCl2 + H2S
- AgNO3 + 2HCl → AgCl + HNO3
- K2CO3 + 2HCl → 2KCl + H2O + CO2
Phản ứng với bazơ
HCl tác dụng với bazơ tạo thành muối và nước. Phương trình phản ứng như sau:
- 2HCl + 2NaOH → 2NaCl + H2O
- 2HCl + Ca(OH)2 → CaCl2 + 2H2O
- 2HCl + Fe(OH)2 → FeCl2 + 2H2O
Phản ứng với các hợp chất oxy hóa
Axit HCl có thể phản ứng với các chất oxy hóa mạnh như K2Cr2O7, KMnO4, MnO2, KClO3, v.v. Trong phản ứng này, chúng đóng vai trò là chất khử mạnh.
- 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
- 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- 2HCl + MnO2 → MnCl2 + Cl2 + H2O
- 6HCl + KClO3 → KCl + 3Cl2 + 3H2O
HCl không phản ứng được với chất nào?
Ngoài những hợp chất tác dụng với HCl mà chúng tôi chia sẻ ở trên, dưới đây là một số chất không tác dụng được:
- Kim loại đứng sau Hydro trong dãy điện hóa là Cu. Ách, Âu,….
- Muối không tan: Muối gốc CO3 và PO4 nhưng không bao gồm K2CO3 và Na2CO3,K3PO4 và Na3PO4)
- Axit: Không hoạt động với tất cả các axit
- Phi kim loại: Không hoạt động với phi kim loại
- Oxit kim loại: Không phản ứng được với oxit kim loại
- Oxit phi kim loại: Không thể phản ứng với oxit phi kim loại
 HCl dùng để xử lý nước trong bể bơi
HCl dùng để xử lý nước trong bể bơi
Kết luận:
Trên đây là toàn bộ đáp án về chủ đề “Tính chất hóa học của HCl”. Hi vọng những thông tin chia sẻ ở trên sẽ giúp ích được nhiều cho bạn. Trong bài viết này chúng tôi tổng hợp những kinh nghiệm trong học tập và cuộc sống, mang đến cho các bạn những kiến thức hữu ích về hóa chất HCl. Từ đó, bạn có thể hiểu rõ hơn về loại hóa chất này. cũng như tìm mua HCl uy tín, chất lượng.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn