Al + Cl2 → AlCl3 – Hướng dẫn cân bằng phản ứng hóa học của tất cả phương trình hóa học thường gặp giúp bạn học tốt môn Hóa.-Al + Cl2 → AlCl3
Al + Cl2 → AlCl3
Phản ứng Al + Cl2 ra AlCl3 thuộc loại phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất.
Bên cạnh đó là một số bài tập có liên quan về Al có lời giải, mời các bạn đón xem:
2Al + 3Cl2 → 2AlCl3
1. Phương trình hoá học của phản ứng Al tác dụng với Cl2
2Al + 3Cl2 → 2AlCl3
2. Nhẩm cân bằng phản ứng hoá học
– Viết sơ đồ phản ứng: Al + Cl2 −−−→ AlCl3.
– Làm chẵn số Cl vế phải bằng thêm hệ số 2 trước AlCl3:
Al + Cl2 −−−→2AlCl3
– Cân bằng số nguyên tử Al ở 2 vế bằng cách thêm hệ số 2 trước Al:
2Al + Cl2 −−−→2AlCl3
– Cân bằng số nguyên tử Cl ở 2 vế bằng cách thêm hệ số 3 trước Cl2:
2Al + 3Cl2 −−−→2AlCl3
– Kiểm tra và hoàn thiện phương trình hoá học: 2Al + 3Cl2 → 2AlCl3
3. Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Al0+C0l2→Al+3Cl3−1
Chất khử: Al; chất oxi hoá: Cl2.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
– Quá trình oxi hoá: Al0→Al+3+3e
– Quá trình khử: Cl20+ 2e→2Cl−1
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
2×3×Al0→Al+3+3eCl20 + 2e → 2Cl−1
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2Al + 3Cl2 → 2AlCl3
4. Điều kiện để Al tác dụng với Cl2
Phản ứng giữa nhôm và Cl2 diễn ra ngay điều kiện thường.
Phản ứng diễn ra nhanh ở nhiệt độ cao.
5. Cách tiến hành thí nghiệm
Cho dây nhôm được đun nóng đỏ vào trong lọ chứa khí clo.
6. Hiện tượng phản ứng
Dây nhôm cháy với ngọn lửa sáng chói.
7.1. Tác dụng với oxi và một số phi kim
– Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
4Al + 3O2→ 2Al2O3
– Bột nhôm bốc cháy khi tiếp xúc với khí clo.
2Al + 3Cl2 → 2AlCl3
7.2. Nhôm tác dụng với axit
– Tác dụng với axit (HCl, H2SO4 loãng,..) giải phóng khí H2.
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
– Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc …
Al + 4HNO3 (loãng) → Al(NO3)3 + NO + 2H2O
Al + 6HNO3 (đặc) → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 (đặc) → Al2(SO4)3 + 3SO2 + 6H2O
Chú ý: Nhôm không tác dụng với H2SO4 (đặc, nguội), HNO3 (đặc, nguội).
7.3. Tác dụng với dung dịch muối của kim loại yếu hơn.
Nhôm có thể tác dụng với dung dịch muối của kim loại yếu hơn để tạo thành muối mới và kim loại mới (đẩy kim loại yếu hơn ra khỏi muối).
Al + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
7.4. Tính chất hóa học riêng của nhôm
Al2O3 là oxit lưỡng tính nên lớp màng mỏng Al2O3 trên bề mặt nhôm tác dụng với dung dịch kiềm tạo ra muối tan. Khi không còn màng oxit bảo vệ, nhôm sẽ tác dụng được với nước tạo ra Al(OH)3 và giải phóng H2; Al(OH)3 là hiđroxit lưỡng tính nên tác dụng trực tiếp với kiềm.
Phản ứng nhôm tác dụng với dung dịch kiềm được thể hiện đơn giản như sau:
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
7.5. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao. Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa sắt(III) oxit và nhôm:
Fe2O3 + 2Al → 2Fe + Al2O3
Nhiệt lượng do phản ứng toả ra lớn làm sắt nóng chảy nên phản ứng này được dùng để điều chế một lượng nhỏ sắt nóng chảy khi hàn đường ray.
Một số phản ứng khác như:
3CuO + 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Cr2O3 + 2Al → Al2O3 + 2Cr
8. Tính chất hoá học của clo (Cl2)
– Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
– Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl–
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
8.1. Tác dụng với kim loại
– Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
– Ví dụ:
2Na + Cl2 →t0 2NaCl
2Fe + 3Cl2 →t02FeCl3
Cu + Cl2 →t0CuCl2
– Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
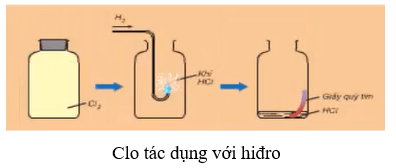
8.2. Tác dụng với hiđro
– Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
– Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 : 1.
– Phương trình hóa học:
H2 + Cl2 →as 2HCl
– Trong phản ứng với H2, clo thể hiện tính oxi hóa.
8.3. Tác dụng với nước
– Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp hydrochloric acid và axit hipoclozơ.
– Phương trình hóa học:
Cl02+H2O⇄HCl−1+HCl+1O
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
– Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
– Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
Mở rộng:
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
– Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH →t0 KClO3 + 5KCl + 3H2O
– Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
– Tác dụng với chất khử khác
3Cl2 + 2NH3 → N2 + 6HCl
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
9. Bài tập vận dụng liên quan
Câu 1: Khí Cl2 ẩm có tính tẩy màu là do
A. Cl2 có tính oxi hóa mạnh.
B. Cl2 tác dụng với nước tạo thành HClO có tính tẩy màu.
C. Cl2 tác dụng với nước tạo thành dung dịch axit.
D. Cl2 vừa có tính oxi hóa, vừa có tính khử.
Hướng dẫn giải:
Chọn B
Khi tan trong nước, một phần khí clo tác dụng với nước theo phản ứng thuận nghịch:
Cl2+H2O⇄HCl+HClO
hypochlorous acid có tính oxi hóa rất mạnh, nó phá hủy các chất màu, vì thế clo ẩm có tác dụng tẩy màu.
Câu 2: Đốt 28 gam bột sắt trong khí clo dư. Khối lượng muối clorua sinh ra là
A. 32,50 gam
B. 24,50 gam
C. 81,25 gam
D. 25,40 gam
Hướng dẫn giải:
Đáp án C
Ta có: nFe = 0,5 mol
→nFeCl3=0,5 mol→mFeCl3=81,25 gam
Câu 3:Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg
B. Al
C. Fe
D. Zn
Hướng dẫn giải:
Đáp án B
M+n2Cl2→MCln
→10,8M=53,4M+35,5n→M=9n
Với n = 3 → M = 27 (Al).
Câu 4: Hiện tượng xảy ra khi cho dây sắt nóng đỏ vào bình đựng khí clo là:
A. Có khói trắng
B. Có khói nâu
C. Có khói đen
D. Có khói tím
Hướng dẫn giải:
Đáp án B
2Fe + 3Cl2 → 2FeCl3 (có màu nâu)
Câu 5. Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình kín chứa khí clo dư, sau phản ứng thì lượng clo trong bình giảm tương ứng 0,4 mol. Khối lượng muối clorua khan thu được là.
A. 65,0 g. B. 38,0 g. C. 50,8 g. D. 42,0 g.
Hướng dẫn giải
Đáp án D
mmuối = mKL+mCl2=13,6+0,4.71=42
Câu 6. Đun nóng Na với Cl2 thu được 11,7 gam muối. Khối lượng Na và thể tích khí clo (đktc) đã phản ứng là
A. 4,6gam; 2,24 lít. B. 2,3gam; 2,24 lít.
C. 4,6gam; 4,48lít. D. 2,3gam; 4,48 lít.
Hướng dẫn giải
Đáp án A
2Na + Cl2 → 2 NaCl
0,2 0,1 0,2 (mol).
Khối lượng Na là: 23 . 0,2 = 4,6g.
Thể tích Cl2: 0,1 . 22,4= 2,24 lít.
Câu 7. Cho clo tác dụng với vừa đủ với Fe rồi hòa tan lượng muối sinh ra vào nước được 100g dung dịch muối có nồng độ 16,25%. Khối lượng sắt và clo (đktc) đã dùng là
A. 0,56 gam; 2,24 lít
B. 5,6 gam; 3,36 lít
C. 11,2 gam; 4,48 lít
D. 1,12 gam; 2,4 lít
Hướng dẫn giải
Đáp án B
mFeCl3 = 100.16,25100 = 16,25g ⇒nFeCl3 = 0,1 mol
2Fe + 3Cl2 → 2FeCl3
0,1 0,15 0,1 (mol).
Khối lượng sắt là: 0,1.56 = 5,6g;
Thể tích clo là: 0,15. 22,4= 3,36 lít.
Câu 8. Cho 14 gam Fe vào bình chứa 10,08 lít clo (đktc) tác dụng với nung nóng rồi lấy chất rắn thu được hoà vào nước và khuấy đều thì thu được 500 g dung dịch X. Nồng độ phần trăm của dung dịch X là
A. 6,35% B. 9,19% C. 8,125% D. 11,43%
Hướng dẫn giải
Đáp án C
2Fe + 3Cl2 → 2FeCl3
Bài cho: 0,25 0,45
Phản ứng: 0,25 0,375 0,25
Sau phản ứng 0 0,075 0,25
⇒ Clo dư
Khối lượng muối thu được là
m = mFeCl3 = 0,25 . 162,5 = 40,625g
⇒ C% = 40,625500.100%= 8,125%
Câu 9. Cho 0,12 mol Al tác dụng vừa hết với đơn chất halogen X2 thu được 16,02 gam muối Y. Cho các phát biểu sau
(1) X thuộc chu kì 3, nhóm VIIA trong bảng HTTH.
(2) X oxi hóa Fe thành muối Fe2+ ở nhiệt độ cao.
(3) X là nguyên tố có độ âm điện lớn nhất trong nhóm halogen.
(4) Phản ứng giữa X2 và H2 gây nổ mạnh ở tỉ lệ thể tích 1:1.
(5) Dung dịch NaX không tác dụng với dung dịch AgNO3 dư.
(6) Muối NaXO được dùng để tẩy rửa.
(7) Điện phân dung dịch là phương pháp duy nhất để điều chế X2.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 6.
Hướng dẫn giải
Đáp án A
2Al+3X2→2AlX30,12↔0,18→0,12 mol
⇒ 0,12. (27 + 3MX) = 16,02
⇒ MX = 35,5 ⇒ X là Clo
Vậy các phát biểu (1); (4) và (6) đúng.
Câu 10. Cho m gam bột Fe tác dụng với khí Cl2 sau khi phản ứng kết thúc thu được m + 12,78 gam hỗn hợp X. Hoà tan hết hỗn hợp X trong nước cho đến khi X tan tối đa thì thuđược dung dịch Y và 1,12 gam chất rắn. Giá trị của m là.
A. 5,6 gam B. 11,2 gam C. 16,8 gam D. 8,4 gam.
Hướng dẫn giải
Đáp án B
Bản chất phản ứng:
2Fe + 3Cl2 →to 2FeCl3
Fe + 2FeCl3 → 3FeCl2
⇒ nFe pư = nClo
⇒m−1,1256=12,7871⇒m=11,2g
Câu 11. Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là.
A. 75,68%. B. 24,32%. C. 51,35%. D. 48,65%.
Hướng dẫn giải
Đáp án B
Đặt số mol Cl2 là x mol; số mol O2 là y mol. Theo bài ra ta có hệ phương trình:
x+y=7,8422,471x+32y=30,1−11,1=19⇔x=0,2y=0,15
Gọi số mol Mg và Al lần lượt là a và b mol. Theo bài ra ta có hệ phương trình:
24a+27b=11,12a+3b=0,2.2+0,15.4⇔a=0,35b=0,1
Vậy %mAl = 0,1.2711,1.100%=24,32%.
Câu 12:Kim loại Al không phản ứng với dung dịch
A.HNO3 đặc, nguội. B. Cu(NO3)2.
C.HCl. D. KOH.
Hướng dẫn giải
Đáp án A
Al không phản ứng với HNO3 đặc, nguội, H2SO4 đặc nguội
Xem thêm các phương trình hóa học hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn