Acetylene + Br2 tỉ lệ 1:1 | C2H2 + Br2 → C2H2Br2 – Hướng dẫn cân bằng phản ứng hóa học của tất cả phương trình hóa học thường gặp giúp bạn học tốt môn Hóa.-Acetylene + Br2 tỉ lệ 1:1 | C2H2 + Br2 → C2H2Br2
Acetylene + Br2 tỉ lệ 1:1 | C2H2 + Br2 → C2H2Br2
Phản ứng acetylene + Br2 tỉ lệ 1 : 1 hoặc C2H2 + Br2 tạo ra C2H2Br2 thuộc loại phản ứng cộng đã được cân bằng chính xác và chi tiết nhất.
Bên cạnh đó là một số bài tập có liên quan về C2H2 có lời giải, mời các bạn đón xem:
C2H2 + Br2 → C2H2Br2
1. Phương trình phản ứng acetylene tác dụng với Br2 (1:1)
HC≡CH + Br2 → BrH2C = CH2Br
2. Điều kiện của phản ứng acetylene tác dụng với Br2 (1:1)
– Phản ứng xảy ra ngay điều kiện thường
3. Hiện tượng của phản ứng acetylene tác dụng với Br2 (1:1)
– acetylene làm nhạt dần mất màu dung dịch brom.
4. Mở rộng về tính chất hoá học của alkyne
4.1. Phản ứng cộng
a) Cộng hiđro
– Khi có niken (hoặc platin hoặc palađi) làm xúc tác, alkyne cộng hiđro tạo thành alkene, sau đó tạo thành alkane.
Thí dụ:
CH ≡ CH + H2 →Ni, to CH2 = CH2
CH2 = CH2 + H2 →Ni, to CH3 – CH3
– Lưu ý: Khi dùng xúc tác là hỗn hợp Pd/PbCO3 hoặc Pd/BaSO4, alkyne chỉ cộng một phân tử hiđro tạo thành alkene.
CH ≡ CH + H2 →Pd/PbCO3, to CH2 = CH2
⇒ Đặc tính này được dùng để điều chế alkene từ alkyne.
b) Cộng brom, clo
– Brom và clo cũng tác dụng với alkyne theo hai giai đoạn liên tiếp.
Thí dụ:
CH ≡ CH + Br2 → CHBr = CHBr
CHBr = CHBr + Br2 → CHBr2 – CHBr2
c) Cộng HX (X là OH, Cl, Br, CH3COO…)
– alkyne tác dụng với HX theo hai giai đoạn liên tiếp.
Thí dụ:
CH ≡ CH + HCl →to, xt CH2 = CHCl
CH2 = CHCl + HCl →to, xt CH3 – CHCl2
– Khi có xúc tác thích hợp, alkyne tác dụng với HCl sinh ra dẫn xuất monochloro của alkene.
Thí dụ:
CH ≡ CH + HCl →150−200CoHgCl2 CH2 = CHCl
– Phản ứng cộng HX của các alkyne cũng tuân theo quy tắc Mac-côp-nhi-côp.
– Phản ứng cộng H2O của các alkyne chỉ xảy ra theo tỉ lệ số mol 1:1.
Thí dụ:
CH ≡ CH + H2O →HgSO4, H2SO4CH3 – CH = O (anehit axetic)
d) Phản ứng đime và trime hoá
2CH ≡ CH →to, xt CH ≡ C – CH = CH2 (vinylacetylene)
3CH ≡ CH →bôt C600Co C6H6 (benzen)
4.2. Phản ứng thế bằng ion kim loại
– Sục khí acetylene vào dung dịch silver nitrate trong amonia, thấy có kết tủa vàng nhạt.
CH ≡ CH + 2AgNO3 + 2NH3 → Ag – C ≡ C – Ag↓ + 2NH4NO3
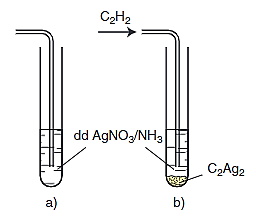
Phản ứng thế nguyên tử hidro của C2H2 bằng ion bạc
a) Trước khi sục khí C2H2.
b) Sau khi sục khí C2H2.
Kết luận:
– Nguyên tử hiđro liên kết trực tiếp với nguyên tử cacbon liên kết ba đầu mạch có tính linh động cao hơn các nguyên tử hiđro khác nên có thể bị thay thế bằng ion kim loại.
– Các ank-1-yne khác như propin, but-1-in, … cũng có phản ứng tương tự acetylene.
⇒ Tính chất này được dùng để phân biệt ank-1-yne với alkene và các alkyne khác.
4.3. Phản ứng oxi hoá
a) Phản ứng oxi hoá hoàn toàn (cháy)
Các alkyne cháy toả nhiều nhiệt:
2CnH2n – 2 + (3n – 1)O2 →to 2nCO2 + 2(n – 1)H2O
b) Phản ứng oxi hoá không hoàn toàn
– Tương tự alkene và alkadien, alkyne cũng có khả năng làm mất màu dung dịch thuốc tím.
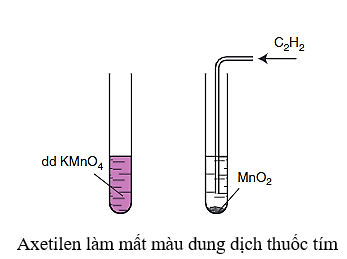
Acetylene làm mất màu dung dịch thuốc tím
5. Bài tập vận dụng liên quan
Câu 1:Một hydrocarbon A phản ứng cộng với dung dịch brom tạo dẫn xuất B chứa 92,48% brom về khối lượng. Công thức cấu tạo của B là
A. CH3CHBr2
B. CHBr2-CHBr2
C. CH2Br-CH2Br
D. CH3CHBr-CH2Br
Hướng dẫn giải:
Đáp án B
Gọi số nguyên tử brom trong B là n, theo giả thiết ta có:
MB=80n.10092,48=86,5n
Nếu n = 2 thì M = 173 (loại, vì khối lượng mol của CxHyBr2 phải là số chẵn)
Nếu n = 4 thì M = 346 → MA = MB – 80.4 = 346 – 320 = 26
Vậy A là C2H2 và B là C2H2Br4
Câu 2: Cho 4,48 lít hỗn hợp khí gồm CH4 và C2H2 qua dung dịch Br2 dư thấy dung dịch nhạt màu và có 2,24 lít khí thoát ra (đktc). Thành phần phần trăm theo thể tích của C2H2 trong hỗn hợp là
A. 25,0%
B. 50,0%
C. 60,0%
D. 37,5%
Hướng dẫn giải:
Đáp án B
Ta có: nhh = 0,2 mol
Nhận thấy: chỉ có C2H2 phản ứng với Br2, khí thoát ra là CH4
→nCH4=0,1 mol
Ta có: nC2H2=0,2−0,2=0,1 mol
→%VC2H2=0,10,2.100%=50%
Câu 3:Đốt cháy hoàn toàn 0,1 mol alkyne được 3,6 gam H2O. Nếu hidro hóa hoàn toàn 0,1 mol alkyne đó rồi đốt cháy thì khối lượng nước thu được là
A. 4,2 gam
B. 5,2 gam
C. 6,2 gam
D. 7,2 gam
Hướng dẫn giải:
Đáp án D
Ta có: nH2O bd=0,2 mol
Gọi công thức phân tử của alkyne là CnH2n-2 (n ≥ 2)
CnH2n−2+3n−12O2→t0nCO2+(n−1)H2O
Ta có: nCO2−nH2O=nCnH2n−2
→nCO2=0,1+0,2=0,3 mol
Lại có: n=nCO2nCnH2n−2=0,30,1=3
→ Công thức phân tử của alkyne là C3H4
Phương trình hóa học:
C3H4+2H2→Ni,t0C3H8 0,1 → 0,1
Khi đốt cháy 0,1 mol C3H8: nH = 0,8 mol
Bảo toàn nguyên tố H: nH2O=12nH=0,4 mol
→nH2O=0,4.18=7,2 gam
Câu 4: Cho 2,24 lít (đktc) một hydrocarbon mạch hở A tác dụng vừa đủ với 200 ml dung dịch brom 1M được sản phẩm chứa 85,56%Br về khối lượng. Công thức phân tử của A là
A. C2H6
B. C3H8
C. C4H6
D. C4H8
Hướng dẫn giải:
Đáp án C
Ta có: nA=0,1 mol;nBr2=0,2 mol
Xét tỉ lệ: T=nBr2nA=0,20,1=2
→ A có công thức phân tử là CnH2n-2
Theo phương trình hóa học:
CnH2n-2 + 2Br2 → CnH2n-2Br4
Theo đề bài: %mBr=80.414n−2+80.4.100%=85,56%
→ n = 4
Vậy công thức phân tử của A là C4H6
Câu 5: Cho 10,8 gam alkyne X tác dụng với 6,72 lít H2 (đktc) có xúc tác thích hợp, thu được hỗn hợp Y (không chứa H2). Biết Y phản ứng tối đa với dung dịch chứa 0,1 mol Br2. Công thức phân tử của X là
A. C2H2
B.C3H4
C. C4H6
D. C5H8
Hướng dẫn giải:
Đáp án C
Gọi công thức phân tử của alkyne là CnH2n−2(n≥2)
Bảo toàn liên kết π:nπ(X)=nH2+nBr2=0,4 mol
Lại có: nX=12nπ(X)=0,2 mol→MX=10,80,2=54→X là C4H6
Câu 6:Hỗn hợp X gồm acetylene, etilen và hydrocarbon A cháy hoàn toàn thu được CO2 và H2O theo tỉ lệ mol 1:1. Dẫn X đi qua bình đựng dung dịch brom dư thấy khối lượng bình tăng thêm 0,82 gam, khí thoát ra khỏi bình đem đốt cháy hoàn toàn thu được 1,32 gam CO2 và 0,72 gam H2O. Phần trăm thể tích của A trong hỗn hợp X là (biết các khí đo ở cùng điều kiện nhiệt độ, áp suất)
A. 25,00%
B. 66,66%
C. 33,33%
D. 75,00%
Hướng dẫn giải:
Đáp án A
Đốt X thu được CO2 và H2O tỉ lệ 1:1
→ A là alkane và nC2H2=nA
Khí thoát ra khỏi brom là khí A
Đốt A có: nCO2=0,03 mol;nH2O=0,04 mol
Ta có: nA=nH2O−nCO2=0,01 mol→nC2H2=0,01 mol
Lại có: nC2H2+nC2H4=0,82 gam→nC2H4=0,02 mol
→%VA=0,010,01+0,01+0,02.100%=25%
Câu 7:4,48 lít (đktc) một hydrocarbon A tác dụng vừa đủ với 400 ml dung dịch brom 1M được sản phẩm chứa 85,56% Br về khối lượng. Công thức phân tử của A là
A. C2H6
B. C3H6
C. C4H6
D. C4H8
Hướng dẫn giải:
Đáp án C
Theo giả thiết ta có: nA=0,2 mol;nBr=0,4 mol→nBr2nA=2
→ A có công thức phân tử là CnH2n-2
Phương trình phản ứng:
CnH2n-2 + 2Br2 → CnH2n-2Br4
Từ giả thiết suy ra: 80.414n−2=85,56100−85,56→n=4→X là C4H6
Câu 8: Cho 4,48 lít hỗn hợp X (ở đktc) gồm 2 hydrocarbon mạch hở lội từ từ qua bình chứa 1,4 lít dung dịch Br2 0,5M. Sau khi phản ứng hoàn toàn, số mol Br2 giảm đi một nửa và khối lượng bình tăng 6,7 gam. Công thức phân tử của hai hydrocarbon là
A. C2H2 và C4H6
B. C2H2 và C4H8
C. C3H4 và C4H8
D. C2H2 và C3H8
Hướng dẫn giải:
Đáp án B
Nếu chỉ có một hydrocarbon phản ứng với dung dịch brom thì ta có:
nC2H2=12nBr2=0,175 mol→nC3H8=0,2−0,175 mol
→mhon hop=0,175.26+0,025.44=5,65(loại)
Vậy cả hai hydrocarbon cùng phản ứng với dung dịch nước brom
nX=0,2 mol;nBr2(ban dau)=0,7 mol→nBr2(phan ung)=0,72=0,35 mol
Khối lượng bình Br2 tăng 6,7 gam là số gam của hỗn hợp X. Đặt công thức trung bình của hai hydrocarbon mạch hở là Cn¯H2n¯+2−2a¯
Phương trình hóa học:
Cn¯H2n¯+2−2a¯+a¯Br2→Cn¯H2n¯+2−2a¯Br2a¯ 0,2 →0,2a¯=0,35
→a¯=1,75→Trong hỗn hợp có một chất chứa 2 liên kết π chất còn lại chứa 1 liên kết π
→14n¯+2−2a¯=6,70,2→n¯=2,5→ trong hỗn hợp phải có một chất là C2H2 (có hai liên kết π) chất còn lại phải có một liên kết π và có số C từ 3 trên lên đó là C4H8
Câu 9: Hỗn hợp X gồm hidro và một hydrocarbon. Nung nóng 14,56 lít hỗn hợp X (đktc), có Ni xúc tác đến khi phản ứng hoàn toàn thu được hỗn hợp Y có khối lượng 10,8 gam. Biết tỉ khối của Y so với methane là 2,7 và Y có khả năng làm mất màu dung dịch brom. Công thức phân tử của hydrocarbon là
A. C3H6
B. C4H6
C. C3H4
D. C4H8
Hướng dẫn giải:
Đáp án C
nX=0,65 mol,MY¯=43,2
Áp dụng định luật bảo toàn khối lượng ta có:
mX=mY=10,8→nX.MX¯=nY.MY¯→nY=0,25 mol
Vì hỗn hợp Y có khả năng làm mất màu dung dịch brom nên hidro phản ứng hết, hydrocarbon còn dư. Như vậy trong hỗn hợp X
nH2=0,65−0,25=0,4 mol;nCxHy=0,25 mol
→ (12x + y).0,25 + 0,4.2 = 10,8 → 12x + y = 40 → x = 3 và y = 4
Vậy hydrocarbon là C3H4
Câu 10: Cho 2,24 lít (đktc) hỗn hợp X gồm C2H4 và C2H2 lội chậm qua bình đựng dung dịch Br2 dư thấy khối lượng bình tăng thêm 2,7 gam. Thành phần phần trăm thể tích của C2H2 có trong hỗn hợp X là
A. 40%
B. 50%
C. 60%
D. 75%
Hướng dẫn giải
Đáp án B
nX=2,2422,4=0,1mol
Gọi số mol của C2H4 và C2H2 lần lượt là x và y mol
→x + y = 0,1 (1)
C2H4+Br2→C2H4Br2x→xxmolC2H2+2Br2→C2H2Br4y→2yy(mol)
Ta có khối lượng bình tăng bằng khối lượng hỗn hợp khí X → 28x + 26y = 2,7 (2)
Từ (1) và (2) →x = y = 0,05
Phần trăm thể tích bằng phần trăm số mol khí.
→%VC2H4=0,050,1.100%=50%%VC2H2=100%−50%=50%
Xem thêm các phương trình hóa học hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn