Nội dung bài viết
Năng lượng hoạt hóa là một khái niệm quan trọng trong hóa học và vật lý, giúp giải thích cách xảy ra các phản ứng hóa học và tại sao một số phản ứng nhanh, trong khi những phản ứng khác chậm. Với vai trò thiết yếu trong nghiên cứu và ứng dụng thực tế, năng lượng hoạt hóa đã trở thành nền tảng cho nhiều ngành công nghiệp và khoa học hiện đại.
1. Năng lượng hoạt động là gì?
Năng lượng kích hoạt (EA) là mức năng lượng tối thiểu mà các phân tử phản ứng cần đạt được cho các phản ứng hóa học. Đây là một rào cản năng lượng ngăn chặn các chất phản ứng ngay lập tức chuyển đổi thành sản phẩm.
Năng lượng hoạt hóa được biểu thị bằng các biểu đồ năng lượng, trong đó:
- Chất phản ứng: ban đầu mức năng lượng thấp.
- Năng lượng hoạt hóa: Đỉnh năng lượng nên được khắc phục để đạt đến trạng thái chuyển tiếp.
- Sản phẩm: Có mức năng lượng thấp hơn (trong phản ứng bức xạ) hoặc phản ứng cao hơn (trong phản ứng thu thập nhiệt).
Ví dụ cụ thể:
- Đốt cháy cục bộ: Than cần được đốt cháy ở nhiệt độ cao (được kích hoạt bởi nhiệt độ từ ngọn lửa) để phản ứng với oxy hóa. Nhiệt từ lửa được kích hoạt năng lượng.
- Phản ứng sinh hóa: Trong cơ thể, các enzyme đóng một vai trò trong việc giảm năng lượng kích hoạt, giúp phản ứng xảy ra dễ dàng mà không có nhiệt độ cao.
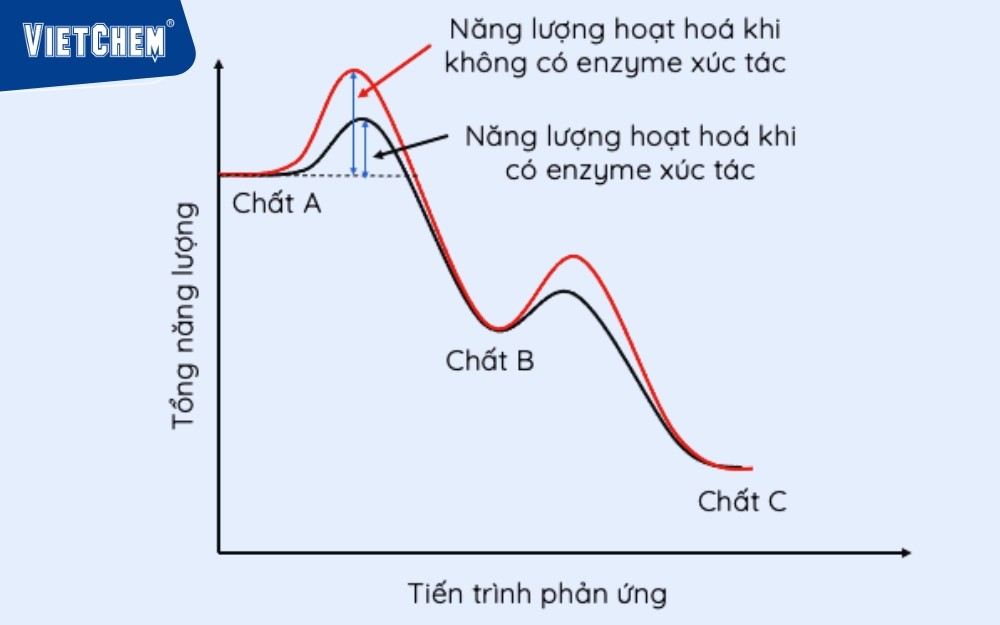
Năng lượng hoạt hóa có chất xúc tác của enzyme
2. Vai trò của năng lượng hoạt hóa
Năng lượng được kích hoạt ảnh hưởng trực tiếp đến tốc độ và khả năng của một phản ứng hóa học. Các vai trò quan trọng bao gồm:
Xác định tốc độ của các phản ứng hóa học:
- Các phản ứng năng lượng hoạt động thấp thường xảy ra nhanh hơn vì các hạt phản ứng dễ dàng vượt qua các rào cản năng lượng.
- Ngược lại, phản ứng với năng lượng kích hoạt cao thường xảy ra chậm, cần nhiều chất nhiệt hoặc chất xúc tác.
Ảnh hưởng đến các điều kiện phản ứng:
- Hiểu năng lượng kích hoạt giúp xác định nhiệt độ, áp suất hoặc các yếu tố thiết yếu để phản ứng hiệu quả. Điều này đặc biệt quan trọng trong các phản ứng công nghiệp, nơi mà hiệu suất và chi phí sản xuất là yếu tố chính.
Ứng dụng trong kiểm soát và tối ưu hóa:
- Năng lượng hoạt hóa là cơ sở để thiết kế các quy trình sản xuất công nghiệp. Các nhà hóa học sử dụng các chất xúc tác để giảm EA, tăng tốc phản ứng mà không tiêu thụ nhiều năng lượng.
3. Các yếu tố ảnh hưởng đến năng lượng hoạt động
Năng lượng hoạt hóa không cố định nhưng có thể thay đổi dưới tác động của các yếu tố bên ngoài:
Nhiệt độ:
- Khi nhiệt độ tăng lên, các hạt phản ứng có nhiều năng lượng hơn để vượt qua rào cản kích hoạt năng lượng, làm tăng tốc độ phản ứng.
- Ví dụ, nấu thức ăn nhanh hơn nhiệt độ cao.

Nấu thức ăn ở nhiệt độ cao
Chất xúc tác:
- Chất xúc tác hoạt động bằng cách cung cấp một đường phản ứng thay thế thấp hơn với năng lượng kích hoạt thấp hơn. Điều này cho phép phản ứng xảy ra nhanh chóng mà không thay đổi nhiệt độ.
- Ví dụ, trong ngành công nghiệp dầu khí, các chất xúc tác bạch kim được sử dụng trong nứt dầu, làm cho quá trình này hiệu quả hơn.
Bản chất của chất phản ứng:
- Các chất phản ứng phân tử đơn giản thường có năng lượng hoạt hóa thấp hơn, trong khi các chất phức tạp hoặc liên kết hóa học mạnh thường đòi hỏi năng lượng hoạt động cao.
4. Áp dụng năng lượng hoạt động trong thực tế
Công nghiệp hóa chất: Mô hình amoniac từ nitơ và khí hydro (quá trình hABER) đòi hỏi năng lượng hoạt động cao. Chất xúc tác sắt được sử dụng để giảm EA, tăng hiệu quả sản xuất.
Công nghệ môi trường: Nước thải và xử lý khí thải: Chất xúc tác trong các phản ứng phân hủy để giảm năng lượng kích hoạt, giúp xử lý chất thải nhanh hơn với chi phí thấp hơn.

Ứng dụng trong xử lý nước thải
Y học và sinh học: Trong cơ thể, enzyme là chất xúc tác sinh học làm giảm sự kích hoạt của phản ứng. Ví dụ, enzyme amylase giúp phá vỡ tinh bột thành glucose nhanh chóng ở nhiệt độ cơ thể.
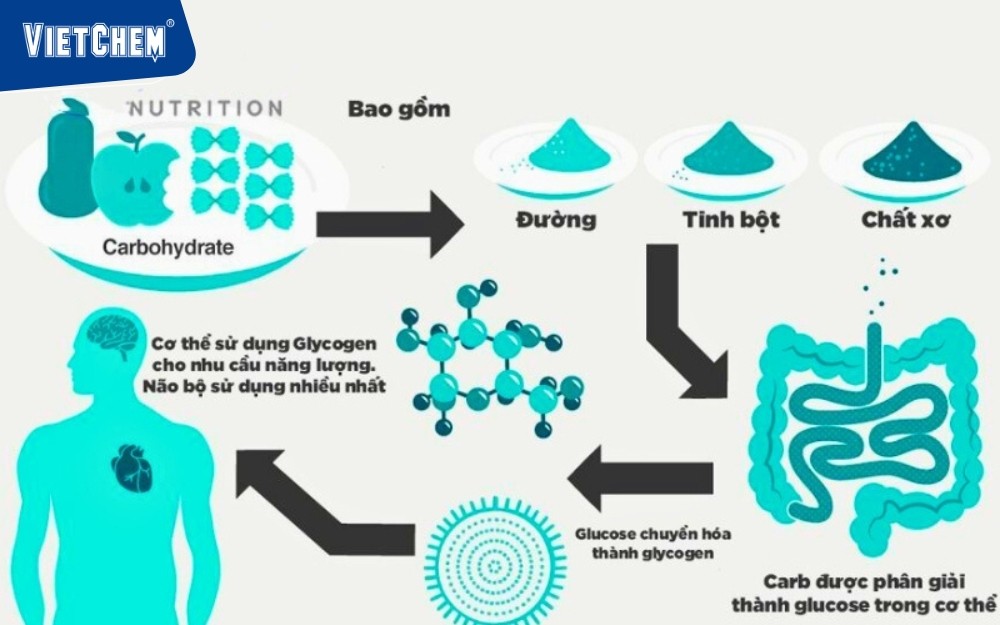
Enzyme amylase giúp phân hủy tinh bột thành glucose
Năng lượng tái tạo: Trong các tế bào nhiên liệu, giảm kích hoạt phản ứng oxy hóa hydro để tăng hiệu quả chuyển đổi năng lượng.
Công nghệ vật liệu: Trong việc sản xuất vật liệu bán dẫn, kích hoạt kiểm soát năng lượng cho phép điều chỉnh quá trình hình thành màng mỏng và cải thiện hiệu suất điện tử.
5. Công thức và cách kích hoạt kích hoạt
Công thức kích hoạt năng lượng thông qua phương trình Arrhenius:
k = ae-EA/rt
Nghĩa:
- K: Hằng số tốc độ phản ứng (tỷ lệ với tốc độ phản ứng).
- A: Hệ số tần số va chạm (phụ thuộc vào bản chất của phản ứng).
- EA: Năng lượng hoạt hóa (J/mol).
- R: Hằng số khí (8.314 j/mol · k).
- T: Nhiệt độ tuyệt đối (Kelvin).
Phân tích:
- Khi EA cao, giá trị K giảm, dẫn đến tốc độ phản ứng chậm.
- Tăng nhiệt độ (T) hoặc giảm EA (bởi chất xúc tác) sẽ làm tăng tốc độ phản ứng.
6. Tại sao năng lượng hoạt động lại quan trọng?
Tối ưu hóa các quy trình công nghiệp: Hiểu năng lượng kích hoạt giúp các nhà khoa học và kỹ sư thiết kế các điều kiện phản ứng tối ưu, giảm chi phí và tăng hiệu quả.
Tiết kiệm năng lượng: Sử dụng các chất xúc tác để giảm EA là một giải pháp quan trọng trong sản xuất năng lượng sạch và phát triển công nghệ bền vững.
Phát triển công nghệ mới: Trong y học, các enzyme nhân tạo được phát triển để tối ưu hóa phản ứng trong cơ thể. Trong ngành công nghiệp năng lượng, nghiên cứu về pin nhiên liệu và vật liệu lưu trữ năng lượng tập trung vào kiểm soát năng lượng vận hành để tăng hiệu quả.
Năng lượng hoạt hóa là một yếu tố cốt lõi giúp giải thích cách các phản ứng hóa học diễn ra và đóng một vai trò quan trọng trong phát triển công nghệ và tối ưu hóa sản xuất. Với khả năng áp dụng đa dạng từ ngành công nghiệp, y học đến năng lượng tái tạo, năng lượng được kích hoạt là chìa khóa để mở ra những tiến bộ khoa học và công nghệ.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn