Nội dung bài viết
AgI có màu gì và hóa chất này có đặc tính gì? Ứng dụng quan trọng như thế nào? Hãy tham khảo thông tin cùng Meraki Center để hiểu rõ hơn về Bạc iodua.
1. Bạc Iốt AgI là gì?
- Bạc iodua là hợp chất giữa bạc và iốt, nó có công thức hóa học AgI.
- Chất không tan trong nước.
- Công thức phân tử: AgI.
- Công thức cấu tạo: Ag – I.
2. Tính chất lý hóa của AgI
2.1 Tính chất vật lý và nhận dạng AgI
AgI là chất rắn, màu vàng sẫm, không tan trong nước, dễ bị phân hủy dưới ánh sáng mặt trời.
Làm thế nào để nhận biết AgI? Hóa chất này khi tiếp xúc với không khí sẽ bị phân hủy khi có ánh sáng, chuyển từ màu vàng sang màu xám của kim loại bạc.
2AgI → 2Ag + I2

Tính chất vật lý và nhận dạng AgI
2.2 Tính chất hóa học của AgI là gì?
Sau đây là những tính chất hóa học nổi bật của Bạc iodua:
Dễ dàng phân hủy:
2AgI → 2Ag + I2
Tác dụng với amoniac:
AgI + H2O + 2NH3 → HI + Ag(NH3)2OH
Phản ứng với dung dịch kiềm đậm đặc:
2NaOH + 2AgI → 2NaI + Ag2O + H2O
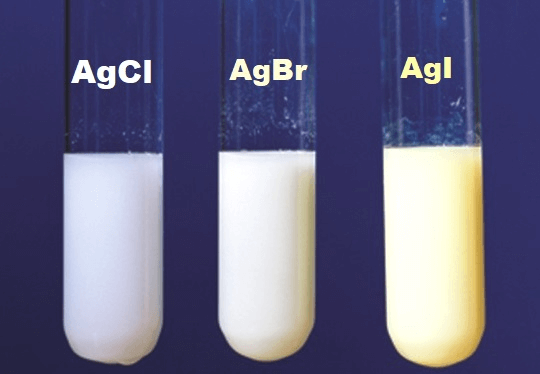
3. AgI có màu gì?
Như chúng ta đã biết, AgI có màu vàng đậm, đặc.
AgI có màu gì?
>>>XEM THÊM: Amoni photphat là gì? Công thức cấu tạo và ứng dụng quan trọng
Amoni photphat là gì? Công thức cấu tạo và ứng dụng quan trọng
4. Tham khảo màu của một số kết tủa, dung dịch quen thuộc
Nếu biết được màu sắc, mùi vị đặc trưng của kết tủa hoặc dung dịch sẽ giúp chúng ta dễ dàng áp dụng chúng trong học tập và công việc. Sau đây là màu sắc của các chất quen thuộc nhưng không phải ai cũng biết:
4.1 Hợp chất Fe
- Fe(OH)3↓: kết tủa màu nâu đỏ
- FeCl2: dung dịch màu xanh nhạt
- FeCl3: dung dịch màu vàng nâu
- Fe3O4 ↓ (rắn): màu nâu sẫm
4.2 Hợp chất Cu
- Cu: màu đỏ
- Cu(NO3)2: dung dịch màu xanh
- CuCl2: tinh thể màu nâu, dung dịch màu xanh lá cây
- CuSO4: tinh thể khan màu trắng, tinh thể ngậm nước màu xanh, dung dịch màu xanh
- Cu2O↓: đỏ gạch
- Cu(OH)2↓: kết tủa màu xanh lam (xanh da trời)
- CuO↓: kết tủa màu đen

Cu(OH)2 là kết tủa màu xanh
4.3 Hợp chất Zn
Zn(OH)2↓: kết tủa keo màu trắng
4.4 Hợp chất Ag
- Ag3PO4↓: kết tủa màu vàng nhạt
- AgCl↓: kết tủa trắng
- AgBr↓: kết tủa màu vàng nhạt (màu trắng ngà)
- AgI↓: kết tủa màu vàng cam (vàng đậm)
- Ag2SO4↓: kết tủa trắng
4.5 Hợp chất của S
- CuS, FeS, Ag2S, PbS, HgS: kết tủa màu đen
- H2S↑ : mùi trứng thối
- SO2↑: mùi hăng, gây ngạt thở
4.6 Hợp chất của N
- NO2↑ : nâu đỏ
- N2O↑ : khí cười
- N2↑ : khí hóa lỏng -196°C
- NO↑ : Hóa nâu trong không khí
- NH3↑ : mùi thơm
4.7 Hợp chất của Na
- NaCN: mùi hạnh nhân, cực độc
- NaCl(r): muối ăn
- NaOH: xút
- NaClO: thành phần của nước Javen, có tính oxi hóa
4.5 Hợp chất của Ca
- CaSO4.2H2O: thạch cao sống
- CaSO4↓ : thạch cao khan
- CaO: vôi sống
- Ca(OH)2 : vôi tôi
4,5 hợp chất Cr
- CrO: đen
- Cr(OH)2↓ : màu vàng hung
- Cr(OH)3↓ : xanh xám
- CrO3: màu đỏ kim loại (độc)
- CrO42- : màu vàng
- Cr2O72- : màu da cam
4.5 Các hợp chất khác
- CdS↓ : màu vàng cam
- MgCO3↓: kết tủa trắng
- BaSO4: kết tủa trắng
- BaCO3: kết tủa trắng
- CaCO3: kết tủa trắng
- PbI2: màu vàng sáng
- C6H2Br3OH↓ : kết tủa màu trắng nhạt
- KMnO4: thuốc tím (thành phần tẩy trắng).
- C6H6Cl6: thuốc trừ sâu 666
- H2O2: hydro peroxit
- CO2↑: gây hiệu ứng nhà kính
- CH4↑ : khí (metan)
- K2SO4.Al2(SO4)3.24H2O : phèn chua
- CH3COOH: có mùi chua của giấm, giấm có nồng độ axit axetic 5%.
- Cl2↑: gây sốc, độc, màu vàng lục
- C3H5(ONO2)3: chất nổ lỏng
5. Điều chế và sản xuất AgI như thế nào?
Có nhiều cách giúp điều chế và sản xuất AgI như sau:
- Cho bạc nitrat phản ứng với kali iodua tạo thành AgI, theo phương trình phản ứng sau:
AgNO3 + KI → AgI + KNO3
- Hòa tan AgI trong axit HI và pha loãng để thu được β-AgI
- Hòa tan AgI vào dung dịch AgNO3 đậm đặc thu được α-AgI[2].
6. Ứng dụng quan trọng của bạc iodua AgI là gì?
- Dùng làm chất khử trùng và thu mây để tạo mưa nhân tạo: Cần khoảng 50.000 kg AgI ở dạng cấu trúc β-AgI để tạo mưa nhân tạo mỗi năm.
- Cũng được sử dụng trong nhiếp ảnh: Bởi vì nó là vật liệu phản ứng khi có ánh sáng nên nó được sử dụng để thu được các vật liệu cảm quang như cuộn ảnh có gắn tinh thể.
- Giúp loại bỏ iốt phóng xạ vì nó rất khó hòa tan.

Các ứng dụng quan trọng của bạc iodide AgI là gì?
7. AgI có nguy hiểm không?
Tiếp xúc quá nhiều với AgI có thể dẫn đến hiện tượng rám nắng bạc, đặc trưng bởi sự đổi màu cục bộ của mô cơ thể.
Gây ra một số thiệt hại khi Silver Iodide hòa tan trong nước.
Nó là một hợp chất độc hại đối với con người, động vật và thực vật. Vì vậy, còn khá nhiều tranh cãi khi sử dụng bạc iodide AgI để giúp điều hòa khí hậu và tạo mưa nhân tạo.

AgI có nguy hiểm không?
8. Mưa nhân tạo là gì và tạo ra nó như thế nào?
8.1 Lịch sử mưa nhân tạo
Người đầu tiên tạo ra mưa nhân tạo là Vincent Schaefer (một nhà hóa học) vào năm 1946, ông đã đưa carbon dioxide vào các đám mây, dẫn đến hiện tượng tuyết rơi ở Schenectady, ngoại ô New York, Mỹ.
Ở Việt Nam, các nhà khoa học cũng đã nghiên cứu mưa nhân tạo từ lâu nhưng việc ứng dụng rất khó khăn, do chi phí cao, công nghệ phức tạp và cần nhiều ngành tham gia. Trận mưa nhân tạo đầu tiên ở Việt Nam xảy ra vào năm 1959 nhờ sự hợp tác với các nhà khoa học Trung Quốc, họ phải dùng máy bay để rắc muối bột lên mây.
8.2 Điều kiện và cách tạo mưa nhân tạo
- Đầu tiên phải có mây. Nếu không có mây thì phải tạo ra (mây nhân tạo) bằng cách đưa máy bay hoặc tên lửa phun, bắn hóa chất (CaCl2, Ca2C và CaO, các hợp chất muối, urê và anlonium nitrat) để kích thích không khí bay lên tạo thành mây.
- Tiếp đến là giai đoạn tích tụ: Số lượng hạt nhân ngưng kết và mật độ hạt tăng lên trong các đám mây.
- Giai đoạn cuối: Máy bay phun lên các đám mây các hóa chất chống đông như bạc iốt (AgI) và đá khô (CO2 đông lạnh). Chúng sẽ gây mất cân bằng và tạo ra nước. Khi có kích thước lớn sẽ rơi xuống đất, đó là mưa nhân tạo.
Hy vọng bài viết này đã giúp các bạn hiểu rõ hơn về AgI có màu gì và những thông tin cần biết về hóa chất Silver iodide, mức độ nguy hiểm của nó và cách tạo mưa nhân tạo. Mời bạn đọc các bài viết tiếp theo của Meraki Center để cập nhật những thông tin hữu ích khác.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn