Nội dung bài viết
Amoni nitrit (công thức hóa học: NH4NO2) là hợp chất hóa học có chứa nitrit (NO2-) và ion amoni (NH4+). Nó thường tồn tại dưới dạng bột màu trắng hoặc vàng nhạt và hòa tan trong nước. Amoni nitrit thường được sử dụng trong các ứng dụng hóa học và công nghiệp, cũng như trong sản xuất các hợp chất khác có chứa nitơ.
1. Amoni nitrit là gì?
Trong bài viết này, chúng ta sẽ nói về công thức ammonium nitrite, còn được gọi là Ammoniumnitrite hoặc Azanium nitrite. Đây là một hợp chất cực kỳ không ổn định và không thể sử dụng ở trạng thái nguyên chất. Ở điều kiện phòng, nó tự phân hủy thành nitơ và nước.
Công thức hóa học của amoni nitrit là NH4NO2.
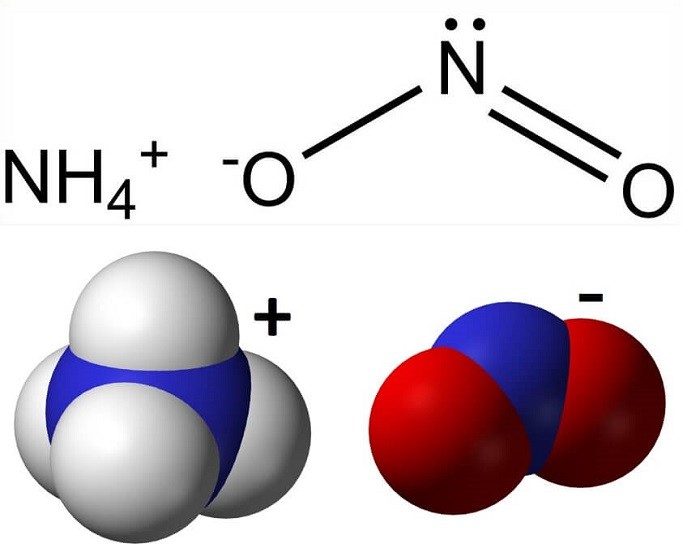 Hình 1: Công thức hóa học của amoni nitrit
Hình 1: Công thức hóa học của amoni nitrit
Amoni nitrit tồn tại tự nhiên trong không khí và có thể được tổng hợp thông qua sự hấp thụ oxit nitric và nitơ dioxide trong amoniac lỏng với tỷ lệ tương đối. Nó cũng có thể được sản xuất bằng cách oxy hóa amoniac bằng hydro peroxide hoặc ozone. Ngoài ra, amoni nitrit có thể được tổng hợp bằng cách kết tủa chì nitrit hoặc bari bằng amoni sunfat, kali nitrit bằng amoni perclorat hoặc amoni clorua bằng bạc nitrit. Kết tủa sau đó được tách ra và làm sạch. Các tinh thể amoni nitrit thu được trong quá trình này không màu và hòa tan trong nước.
2. Tính chất của amoni nitrit
Amoni nitrit (NH4NO2) là hợp chất không ổn định và có nhiều tính chất đặc biệt. Dưới đây là một số tính chất quan trọng của amoni nitrit:
- Không ổn định và phân hủy: Amoni nitrit là một chất rất không ổn định. Ở nhiệt độ và áp suất bình thường, nó dễ dàng phân hủy thành nitơ (N2) và nước (H2O) theo phản ứng sau: NH4NO2 -> N2 + 2H2OĐiều này khiến amoni nitrit không thể bảo quản hoặc sử dụng trong điều kiện bình thường mà không cần có biện pháp phòng ngừa đặc biệt.
- Tính chất tan trong nước: Amoni nitrit hòa tan tốt trong nước tạo thành dung dịch nitrit axit (HNO2). Dung dịch này có thể tạo ra phản ứng hóa học và tạo điều kiện gây nổ nếu xử lý không đúng cách.
- Tạo khí nitơ (N2): Đặc tính phân hủy của amoni nitrit làm cho nó trở thành nguồn nitơ (N2) tốt trong các ứng dụng cần nitơ.
3. Ứng dụng amoni nitrit
Ammonium Nitrite (NO₂⁻) không phải là sản phẩm có nhiều ứng dụng trực tiếp trong cuộc sống hàng ngày như các hợp chất Nitơ khác. Thay vào đó, nó thường xuất hiện trong các quá trình sinh học và hóa học, đặc biệt là trong xử lý nước thải và trong một số phản ứng hóa học cụ thể. Dưới đây là một số ứng dụng quan trọng của amoni nitrit:
- Xử lý nước thải: Amoni Nitrit xuất hiện trong quá trình xử lý nước thải sinh học. Trong quá trình này, các vi sinh vật như Nitrosomonas chuyển đổi amoni (NH₄⁺) thành Nitrite (NO₂⁻) trong quá trình Nitrat hóa. Điều này giúp loại bỏ các hợp chất amoni gây ô nhiễm khỏi nước thải, tạo điều kiện xử lý nước thải an toàn hơn.
- Quản lý hồ cá và ao nuôi: Trong ngành nuôi trồng thủy sản và ao cá, việc đo Ammonium Nitrite có thể giúp theo dõi những thay đổi trong môi trường nước. Sự gia tăng đột ngột của Ammonium Nitrite có thể là dấu hiệu của sự mất ổn định trong hệ thống nuôi và điều này cần được kiểm soát để đảm bảo sức đề kháng của cá và sự phát triển của sinh vật nuôi.
- Phân tích và nghiên cứu hóa học: Trong phòng thí nghiệm và nghiên cứu, Ammonium Nitrite có thể được sử dụng làm chất thử hoặc thuốc thử để thực hiện các phản ứng hóa học cụ thể.

Hình 2: Ứng dụng amoni nitrit trong xử lý nước thải
4. Ảnh hưởng của amoni nitrit đến quá trình xử lý nước thải
Hàm lượng Amoni và Nitơ tổng số trong nước thải đóng vai trò quan trọng trong việc đánh giá chất lượng nước thải theo tiêu chuẩn QCVN của Bộ Tài nguyên và Môi trường. Để hiểu điều này, chúng ta cần xem xét sự hình thành của Ammonium Nitrite, một chỉ số chính đánh giá hiệu suất xử lý nước thải.
Sự hình thành Ammonium Nitrite đòi hỏi sự có mặt của cả Amoni và Nitrite, và nó xảy ra trong quá trình Nitrat hóa. Sự xuất hiện của Ammonium Nitrite trong xử lý nước thải cho thấy quá trình nitrat hóa có thể chưa được thực hiện hoàn toàn.
Cụ thể, quá trình Nitrat hóa có thể được mô tả bằng hai phương trình sau:
- NH₃ + O₂ -> NO₂ + 3H⁺ + 2e⁻
- NO₂⁻ + H₂O -> NO₃ + 2H⁺ + 2e⁻
Bằng cách xem xét hai phương trình này, chúng tôi nhận thấy rằng nếu quá trình (2) không được thực hiện một cách triệt để hoặc tối ưu thì Ammonium Nitrite sẽ được tạo ra. Khi Nitrite không được chuyển đổi hoàn toàn thành Nitrate, quá trình khử nitrat tiếp theo để chuyển Nitrate thành khí Nitơ tự do (N₂) không thể diễn ra. Kết quả là nước thải cuối cùng sẽ không đạt tiêu chuẩn xả thải về chỉ tiêu nitơ.
5. Giảm thiểu sự hình thành Amoni Nitrit trong xử lý nước thải
Sử dụng vi sinh vật bổ sung vào hệ thống xử lý nước thải nhằm kích thích quá trình nitrat hóa nhanh và ổn định là chiến lược đã được nhiều tổ chức áp dụng nhằm giảm thiểu sự hình thành Ammonium Nitrite trong nước thải. quá trình xử lý nước thải. Có hai chủng vi sinh vật chuyên biệt thường được sử dụng trong quá trình này là Nitrosomonas và Nitrobacter.
Trong quá trình xử lý nước thải sinh học, khi hai chủng vi sinh vật Nitrosomonas và Nitrobacter tham gia vào quá trình nitrat hóa sẽ thực hiện hai bước quan trọng. Ban đầu, họ oxy hóa Amoni (NH₄⁺) thành Nitrite (NO₂⁻) như sau: Sau đó, họ tiếp tục oxy hóa Nitrite thành Nitrate (NO₃⁻) trong bước tiếp theo: Bước tiếp theo của quá trình xử lý nước thải là quá trình khử nitrat trong đó NO₃⁻ là bị khử thành khí N₂.
Để đảm bảo xử lý hiệu quả Ammonium Nitrite trong nước thải, điều quan trọng là phải tạo điều kiện thuận lợi cho 2 loại vi sinh vật này phát triển và hoạt động hiệu quả. Các điều kiện môi trường quan trọng bao gồm độ kiềm, pH, nồng độ oxy hòa tan trong nước, nhiệt độ, tuổi của bùn, độ mặn, ánh sáng và nhiều yếu tố khác.
Trên đây là toàn bộ những thông tin về Amoni nitrit mà Vietchem cung cấp cho bạn. Hi vọng thông tin này sẽ hữu ích với bạn


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn