Nội dung bài viết
Ăn mòn hóa học là một hiện tượng phổ biến ảnh hưởng đến tất cả các khía cạnh của cuộc sống và công nghiệp. Hiện tượng này xảy ra khi vật liệu, thường là kim loại, bị phá hủy do phản ứng hóa học với môi trường xung quanh. Hiểu cơ chế và kiểm soát ăn mòn giúp chúng tôi bảo vệ tài sản và đảm bảo an toàn trong nhiều lĩnh vực.
1. Bản chất của sự ăn mòn hóa học
Ăn mòn hóa học là quá trình của các phản ứng hóa học hoặc điện hóa giữa các bề mặt kim loại và môi trường. Điều này dẫn đến sự suy giảm tính chất cơ học, vật lý hoặc hóa học của vật liệu. Một ví dụ quen thuộc là sự rỉ sét của sắt khi tiếp xúc với oxy và độ ẩm trong không khí.
Bản chất của sự ăn mòn hóa học:
- Là một phản ứng tự nhiên không thể tránh khỏi.
- Thường xảy ra trong bề mặt tiếp xúc giữa kim loại và môi trường.
- Có thể làm giảm tuổi thọ của vật liệu và gây ra tổn thất kinh tế lớn.
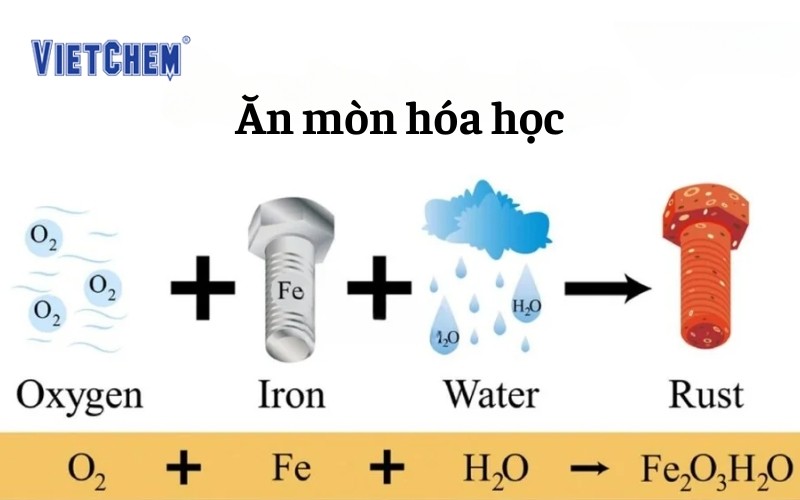
2. Nguyên nhân của sự ăn mòn hóa học
Ăn mòn hóa học bị chi phối bởi nhiều yếu tố, bao gồm:
Các yếu tố môi trường
- Nước: là chất xúc tác chính trong quá trình ăn mòn.
- Oxy: Phản ứng oxy hóa tạo ra rỉ sét trên kim loại.
- CO₂: Tạo điều kiện cho phản ứng tạo ra axit carbon ăn mòn.
- PH: Môi trường axit hoặc kiềm cao đều tăng tốc độ ăn mòn.
- Nhiệt độ: Nhiệt độ cao tăng tốc phản ứng hóa học.
Tác động của con người
- Ô nhiễm môi trường do khí thải công nghiệp.
- Sử dụng hóa chất không kiểm soát mạnh.
- Chọn vật liệu không phù hợp trong thiết kế.
3. Làm thế nào để ngăn chặn và kiểm soát sự ăn mòn hóa học
3.1. Sử dụng vật liệu ăn mòn
Thép không gỉ: Một loại thép chứa một lượng lớn crom, tạo ra một lớp oxit bảo vệ trên bề mặt kim loại, ngăn chặn sự ăn mòn.
Hợp kim nhôm-magie: Những hợp kim này rất bền và có khả năng chống ăn mòn tự nhiên.
Vật liệu không phải là vật liệu: Các vật liệu như nhựa, composite, cao su thường không bị ăn mòn và được sử dụng để thay thế kim loại trong môi trường khắc nghiệt.

Vật liệu chống trễ
3.2. Bảo vệ bề mặt
Bảo vệ bề mặt kim loại là một trong những phương pháp phổ biến nhất để ngăn chặn sự ăn mòn hóa học. Các kỹ thuật bao gồm:
Vỏ sơn chống lại: Lớp sơn tạo ra một rào cản vật lý để tách kim loại với môi trường. Các loại sơn epoxy, urethane và kẽm thường được sử dụng trong ngành công nghiệp.
Sử dụng lớp phủ polymer hoặc cao su: đặc biệt hữu ích trong môi trường axit hoặc kiềm, chẳng hạn như cây hóa học.
Mạ kim loại: mạ kẽm (mạ kẽm): lớp kẽm bảo vệ kim loại khỏi quá trình oxy hóa. Niken mạ hoặc Chrome: Tăng khả năng chống ăn mòn và cải thiện tính thẩm mỹ.

Bảo vệ bề mặt bằng cách ăn mòn lớp phủ
3.3. Sử dụng các chất ức chế ăn mòn
Các chất ức chế ăn mòn là các hợp chất hóa học được thêm vào môi trường để làm chậm quá trình ăn mòn. Các loại phổ biến bao gồm:
Các chất ức chế hữu cơ: Tạo một màng bảo vệ trên bề mặt kim loại.
Các chất ức chế vô cơ: Điều chỉnh pH hoặc phản ứng với các ion gây ra sự ăn mòn để ngăn chặn sự phá hủy.
4. So sánh ăn mòn hóa học và ăn mòn điện hóa
| Tiêu chí | Ăn mòn hóa học | Ăn mòn điện |
| Định nghĩa | Một hiện tượng phá hủy kim loại do các phản ứng hóa học trực tiếp với các chất trong môi trường (không có dòng điện tham gia). | Sự ăn mòn kim loại xảy ra khi dòng điện được hình thành bởi các phản ứng điện hóa trong môi trường dẫn điện. |
| Cơ chế | Phản ứng giữa kim loại và khí hoặc chất lỏng như oxy, hơi nước hoặc axit. | Liên quan đến sự khác biệt về điện áp điện cực giữa hai vùng trên cùng một kim loại hoặc giữa hai kim loại khác nhau. |
| Điều kiện xảy ra | – Không cần chất điện giải. – Xảy ra trong môi trường khô hoặc ẩm. | – Cần phải có chất điện giải (nước, dung dịch muối, axit, kiềm). – Cần hai kim loại khác nhau hoặc tính không đồng nhất trên bề mặt. |
| Phản ứng ví dụ | – Sắt phản ứng với oxy và nước: 4fe + 3O₂ + 6H₂O → 4FE (OH) ₃ (rỉ sét). | – Sắt trong dung dịch muối: Fe (cực dương) bị oxy hóa, trong khi oxy hoặc kim loại khác bị giảm ở cực âm. |
| Khu vực phản ứng | Phản ứng xảy ra đồng đều trên toàn bộ bề mặt tiếp xúc. | Phản ứng xảy ra cục bộ trong hai lĩnh vực: – Anode: kim loại bị oxy hóa. – Cathode: Giảm phản ứng xảy ra. |
| Các yếu tố môi trường | – oxy, Co₂, axit hoặc khí ăn mòn. – Không có yêu cầu môi trường dẫn điện. | – Tác nhân điện (như nước biển, dung dịch muối hoặc axit). – Yêu cầu môi trường dẫn điện để tạo ra các ion. |
| Ví dụ thực tế | – Đồng bị oxy hóa trong không khí ẩm tạo ra một vết gỉ đồng xanh (CUCO₃ · cu (OH)). | – Thuyền bị ăn mòn trong nước biển do tiếp xúc giữa sắt và kẽm. |
| Điều khiển | – Sử dụng vật liệu bền hóa học. – Bảo vệ bề mặt bằng cách phủ, chẳng hạn như sơn hoặc polymer. | – Sử dụng các biện pháp bảo vệ catốt. – mạ kim loại hoặc thêm chất ức chế ăn mòn. |
5. Câu hỏi thường gặp
- Ăn mòn hóa học khác với ăn mòn vật lý? Ăn mòn hóa học liên quan đến các phản ứng hóa học, trong khi ăn mòn vật lý chỉ là tổn thất cơ học.
- Tại sao kim loại dễ dàng bị ăn mòn? Bởi vì kim loại rất dễ bị mất electron trong các phản ứng hóa học.
- Làm thế nào để giảm sự ăn mòn của ngành? Sử dụng vật liệu chống vi khuẩn và kiểm soát môi trường.
- Có tài liệu nào không bị ăn mòn? Không có vật liệu hoàn toàn miễn dịch, nhưng thép không gỉ và hợp kim đặc biệt có khả năng chống ăn mòn cao.
- Ăn mòn ảnh hưởng đến môi trường là gì? Gây ô nhiễm do rỉ sét và bởi các sản phẩm ăn mòn.
- Công nghệ mới nhất trong ăn mòn là gì?


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn