Nội dung bài viết
Axit là một phần không thể thiếu trong cuộc sống. Chúng tồn tại xung quanh chúng ta và đóng vai trò quan trọng trong sự sống còn của các sinh vật sống. Vậy axit là gì? Có những loại axit nào và tính chất của chúng là gì? Và axit được sử dụng như thế nào trong cuộc sống? Hãy cùng vietchem tìm hiểu về axit qua bài viết dưới đây nhé!
1. Axit là gì?
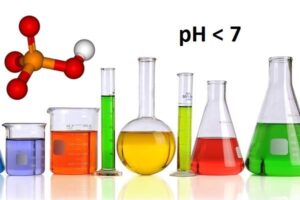
Khái niệm axit dùng để chỉ một hợp chất hóa học có công thức HxA (trong đó x là chỉ số của nguyên tử H, A là gốc Axit), chúng sẽ có vị chua và tan trong nước tạo thành dung dịch có tính axit cao. pH < 7. pH càng lớn thì tính axit càng yếu và ngược lại, oH càng thấp thì tính axit càng mạnh.
Có một định nghĩa khác về axit đó là “axit là các phân tử hoặc ion có khả năng nhường proton H+ cho bazơ hoặc nhận các cặp electron không chia sẻ từ bazơ”.
Axit tan trong nước sẽ tạo dung dịch có pH < 7
2. Có những loại axit nào? Phân loại axit
Axit được phân loại dựa trên một số tiêu chí như sau:
2.1. Dựa vào tính chất hoá học của axit
-
Các axit mạnh: axit sulfuric H2SO4, axit clohydric HCl, axit nitric HNO3,… Khi hòa tan các axit này vào nước sẽ tạo ra dung dịch có pH nhỏ hơn 7 rất nhiều.
-
Các axit yếu: Axit cacbonic H2CO3, Hydro sunfua H2S,… Khi hòa tan các axit này vào nước sẽ tạo ra dung dịch có pH gần 7.
2.2. Dựa trên nguyên tử oxy
- Axit không có oxy: HCl, HI, H2S, HBr, HF…
- Axit có oxi: H2SO4, H3PO4, H2CO3, HNO3,…
2.3. Phân loại khác
- Axit vô cơ: HCl, HNO3, H2SO4,…
- Axit hữu cơ – RCOOH: HCOOH, CH3COOH,…
Tổng quan về axit
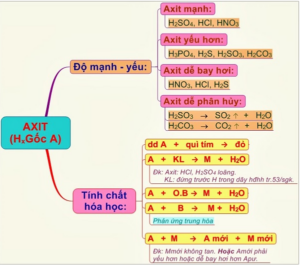
3. Cách xác định độ mạnh và điểm yếu của axit
- Dựa vào độ linh động của nguyên tử Hydro trong axit đó. Nếu H linh động hơn thì tính axit mạnh hơn và ngược lại.
- Với các axit có chứa oxy trong cùng một nguyên tố thì càng ít oxy thì axit càng yếu
HClO4 > HClO3 > HClO2 > HClO
- Với axit của các nguyên tố cùng chu kỳ, khi các nguyên tố có hóa trị cao nhất thì nguyên tố trung tâm là phi kim càng yếu thì axit càng yếu.
HClO4> H2SO4> H3PO4
- Với axit của các nguyên tố cùng nhóm A
+ Axit với oxy: Độ axit tăng dần từ dưới lên trên: HIO4 < HbrO4 < HClO4
+ Axit không có oxy: Độ axit giảm dần từ dưới lên trên: HI > HBr > HCl > HF
- Với axit hữu cơ RCOOH
+ Nếu R đẩy electron (R không có gốc tự do) thì tính axit giảm
HCOOH> CH3COOH> CH3CH2COOH> CH3CH2CH2COOH> n-C4H9COOH.
+ Nếu R hút electron (gốc R không bão hòa, có mùi thơm hoặc có nguyên tố halogen, v.v.) thì tính axit sẽ mạnh
4. Tính chất của axit
4.1 Tính chất vật lý của axit
- Hòa tan trong nước, có vị chua.
- Khi tiếp xúc với axit mạnh sẽ có cảm giác đau nhói.
- Là chất điện phân, nó có thể dẫn điện.
4.2 Tính chất hóa học của axit
- Thay đổi màu của chất chỉ thị (quỳ quỳ, giấy chỉ thị pH, dung dịch phenol phthalein).
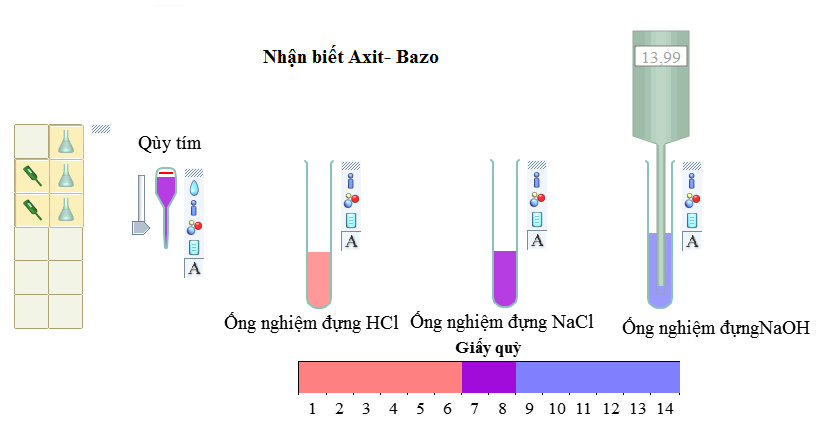
Axit làm đổi màu quỳ tím
- Phản ứng với một số kim loại tạo thành muối và giải phóng hydro. Axit sulfuric đậm đặc và axit nitric nóng có thể phản ứng với hầu hết các kim loại, tạo ra sulfur dioxide SO2 (H2SO4) hoặc nitơ dioxide NO2 (HNO3).
HCl + Fe -> FeCl2 + H2
2Fe + 6H2SO4 -> Fe2(SO4)3 + 6H2O + 3SO2
- Tác dụng với bazơ tạo thành muối và nước
Cu(OH)2 + H2SO4 -> CuSO4 + 2H2O
- Phản ứng với oxit bazơ tạo thành muối + nước
Na2O + 2HCl → 2NaCl + H2
FeO + H2SO4 (pha loãng) → FeSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
- Phản ứng với muối tạo ra muối mới và axit mới
4.3 Điều kiện xảy ra phản ứng
- Muối phản ứng là muối hòa tan.
- Muối mới không tan trong axit mới.
- Sản phẩm có chứa chất kết tủa hoặc chất dễ bay hơi.
H2SO4 + BaCl2 → BaSO4(r) + 2HCl
K2CO3 + 2HCl → 2KCl + H2O + CO2 (axit cacbonic phân hủy thành nước và cacbonic)
5. Một số ứng dụng quan trọng của axit trong đời sống
- Người ta thường sử dụng axit trong quá trình “tẩy”, loại bỏ rỉ sét và ăn mòn trên kim loại.
- Axit sulfuric (H2SO4) được sử dụng làm chất điện phân trong sản xuất ắc quy ô tô.
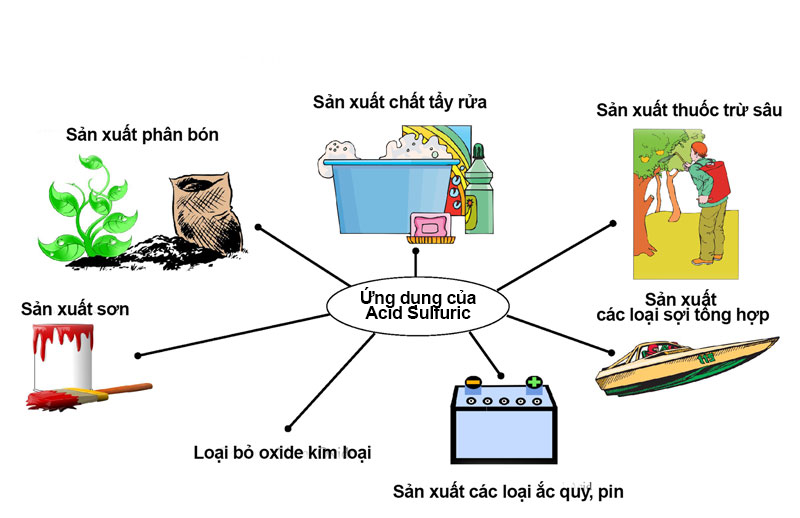
Ứng dụng của axit sunfuric
- Axit cacboxylic có thể được este hóa bằng rượu để tạo ra este.
- Axit mạnh được sử dụng rộng rãi trong các ngành công nghiệp như công nghiệp hóa chất và chế biến khoáng sản.
- Trong ngành khai thác dầu khí, Axit clohydric (HCl) được sử dụng rộng rãi trong ngành khai thác dầu khí, hỗ trợ đắc lực cho việc khoan giếng dầu.
- Trong chế tác đồ trang sức, người ta dùng HCl và HNO3 đậm đặc trộn với nhau theo tỷ lệ 3:1 để hòa tan vàng và bạch kim.
- Axit còn được dùng làm chất phụ gia trong chế biến và bảo quản thực phẩm, đặc biệt là trong đồ uống.
- Để sản xuất phân bón amoni nitrat, người ta dùng amoniac để phản ứng với axit nitrat.
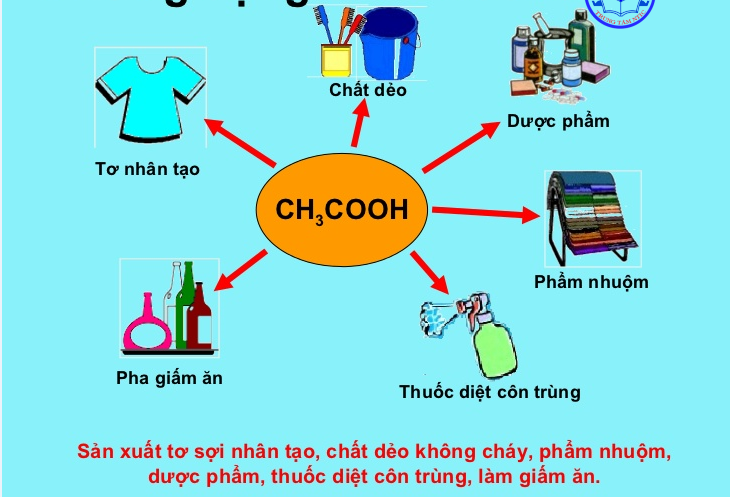
Một số ứng dụng của axit axetic
- Trong y học
– Axit axetylsalicylic được dùng làm thuốc hạ sốt, giảm đau.
– Axit boric được dùng để sát trùng các vết thương hở nhỏ và vết bỏng. Dung dịch rửa mắt cũng có thể thu được bằng cách pha loãng axit boric. Không những vậy, nó còn là chất kháng khuẩn dùng để điều trị mụn nước ở vận động viên và mụn trứng cá. Dùng làm chất bảo quản mẫu nước tiểu trong phòng thí nghiệm.
- Axit amoni được sử dụng để tổng hợp các protein cần thiết cho việc sửa chữa các mô cơ thể và sự phát triển của sinh vật.
- Axit nucleic rất cần thiết cho việc sản xuất DNA và RNA và truyền các đặc tính cho con cái thông qua gen.
- Axit cacbonic cần thiết để duy trì sự cân bằng độ pH trong cơ thể.
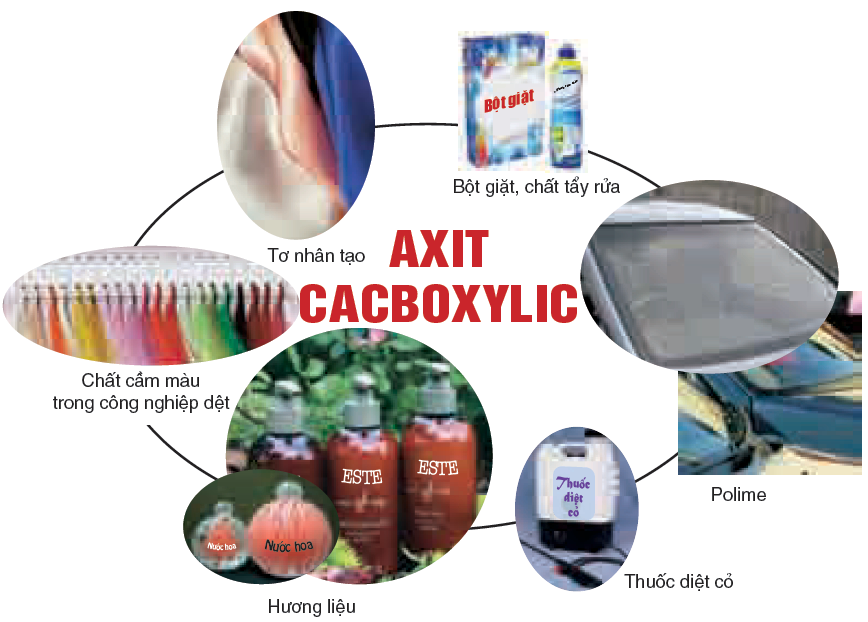
Ứng dụng của axit cacbonic
6. Một số axit thông dụng do Meraki Center cung cấp
- Axit clohydric HCl 30% – 35%, Việt Nam, 30kg/lon
- Axit sunfuric – Hóa chất công nghiệp quan trọng nhất hiện nay
- Axit citric C6H8O7.H2O 99,5%, Trung Quốc, 25kg/bao
- Axit sunfuric H2SO4 10% – 98%, Việt Nam, 35kg/lon
- Axit clohiđric HCl là gì? Phương pháp điều chế và sản xuất axit clohydric
- Axit axetic (CH3COOH) 99%, Hàn Quốc, 30kg/lon
….
Trên đây là những chia sẻ của vietchem về axit là gì? Tính chất hóa học của axit và một số ứng dụng thực tế. Hi vọng bạn có thêm nhiều thông tin hữu ích cho mình. Hiện nay Meraki Center có sẵn nhiều loại axit chất lượng như axit axetic, axit sulfuric,… Quý khách có nhu cầu mua hàng vui lòng liên hệ trực tiếp HOTLINE 0826 010 010 để được tư vấn tốt nhất.
=>> XEM THÊM:
- Axit amin là gì? VAI TRÒ CỦA AXIT AMIN ĐỐI VỚI SỨC KHỎE CON NGƯỜI



Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn