Nội dung bài viết
HCl được điều chế như thế nào trong phòng thí nghiệm và trong công nghiệp? Hãy cùng Vũ Hoàng Chemical tìm hiểu trong bài viết này nhé.
HCl là tên công thức hóa học của Axit Clohydric. Đây là một trong những chất vô cơ được sử dụng rộng rãi trong đời sống hiện nay. Vậy HCl được điều chế như thế nào trong phòng thí nghiệm và trong công nghiệp? Nếu bạn đang thắc mắc về vấn đề này thì đừng bỏ lỡ bài viết sau đây của Vũ Hoàng Chemical.
I. Cách điều chế HCl trong phòng thí nghiệm và công nghiệp
1. Điều chế HCl trong phòng thí nghiệm
Điều chế HCl trong phòng thí nghiệm sẽ sử dụng phương pháp sunfat, thông qua phản ứng của axit sunfuric đậm đặc với muối clorua. Với phương pháp này, nồng độ HCl có thể lên tới 40%.
1.1 Công thức điều chế HCl trong phòng thí nghiệm bằng phương pháp sunfat như sau:
NaCl rắn + H2SO4 đậm đặc → NaHSO4 + HCl (
2NaCl rắn + H2SO4 đậm đặc → Na2SO4 + 2HCl (> 400 độ C)
Trong quá trình thí nghiệm, khí HCl sinh ra sẽ được dẫn qua nước thu được Axit clohydric. Hiện nay, phương pháp Sulfate không được sử dụng để điều chế HBr và HI vì Axit Sulfuric sẽ oxy hóa HBr và HI thành Br2 và I2 khiến bromide và iodide bị thất thoát trong quá trình điều chế. Cụ thể phản ứng oxi hóa khử như sau:
H2SO4 đậm đặc + 2HBr → SO2 + Br2 + 2H2O
H2SO4 + 2HI đậm đặc → SO2 + I2 + 2H2O
Điều chế HCl bằng cách cho kim loại kiềm phản ứng với axit clohiđric. Đây là cách điều chế HCl trong các thí nghiệm để có nồng độ HCl thấp hơn. Khi thực hiện thí nghiệm, các kim loại kiềm như Li, Na, K, Rb,… có tính khử mạnh. Khi phản ứng với Axit clohiđric sẽ tạo ra muối Clorua và khí Hydro.
Phương pháp này có phương trình điều chế HCl sau:
M + HCl → MCl + H2
Trong đó: M là kim loại kiềm
Trong quá trình thí nghiệm, khí hydro sinh ra có thể được thu hồi hoặc đốt cháy tùy theo nhu cầu sử dụng. HCl sẽ được hấp thụ vào nước thu được dung dịch Axit clohydric.
Ngoài 2 cách điều chế HCl trên mà chúng tôi chia sẻ.
1.2 Bạn có thể tham khảo một số cách khác như:
- Để các hợp chất clorua như C2C2H5Cl, NH4Cl, ICl,… phản ứng được với các axit mạnh như HNO3, H2SO4…
- Để các hợp chất clorua chứa kim loại quý như AgCl, HClO4,… phản ứng với các chất khử mạnh như Zn, Al…
- Để các hợp chất clorua kim loại kiềm như NaClO3, KClO4… phản ứng được với các axit mạnh như H2SO4, H3PO4…
Tuy nhiên, những phương pháp điều chế HCl trong phòng thí nghiệm này hiếm khi được sử dụng. Do chi phí cao, hiệu quả thấp hoặc nguy hiểm trong quá trình thực hiện.
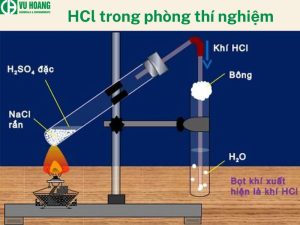 Điều chế HCl trong thí nghiệm
Điều chế HCl trong thí nghiệm
2. Cách điều chế HCl trong công nghiệp
Không giống như cách điều chế trong phòng thí nghiệm, HCl được điều chế rất đơn giản trong công nghiệp. Quá trình này được thực hiện bằng cách đốt HCl thành khí clo và khí hydro trong bể. Sau đó sẽ thu được các tinh thể chứa chất xúc tác như Pt hoặc Ni. Phản ứng này sẽ xảy ra khi đốt cháy ở nhiệt độ cao 400°C và áp suất khoảng 10 atm. Đây là phản ứng có khả năng duy trì và tỏa một lượng nhiệt lớn.
Đốt hydro trong khí clo là phương pháp điều chế HCl trong công nghiệp, mang lại năng suất cao và chi phí thấp. Khí hydro và clo sẽ được tạo ra thông qua quá trình điện phân dung dịch muối ăn (NaCl) bằng màng. Sau đó, cả hai loại khí này sẽ được đưa vào bình đốt ở nhiệt độ cao sẽ thu được khí HCl. Điều chế axit clohydric bằng phương pháp này sẽ có phản ứng hóa học sau:
H2 + Cl2 → 2HCl
3.Lưu ý khi điều chế Axit Clohydric
Việc điều chế axit clohydric (HCl) đòi hỏi phải cẩn thận. Bởi loại axit này có tính ăn mòn mạnh và có thể gây cháy nếu tiếp xúc với một số chất. Dưới đây là một số lưu ý quan trọng khi pha chế Axit Clohydric:
3.1 Điều kiện làm việc an toàn:
Làm việc trong môi trường có đủ thông gió để thoát khí HCl. Đảm bảo không có khí tích tụ trong không gian làm việc. Đảm bảo sử dụng thiết bị bảo hộ cá nhân, bao gồm áo choàng, kính bảo hộ, găng tay và mặt nạ phòng độc thích hợp.
3.2 Sử dụng nguồn nhiệt an toàn:
Việc điều chế Axit clohydric thường sử dụng dung dịch HCl từ bình chứa, chẳng hạn như Axit clohydric 37%. Nếu cần đun nóng dung dịch HCl, hãy sử dụng bếp đun nóng an toàn và đảm bảo nhiệt độ không quá cao.
3.3 Tránh tiếp xúc với không khí:
Axit clohiđric là axit mạnh, khi để ngoài không khí sinh ra khí HCl. Điều này có thể tạo ra môi trường có độ ẩm cao, gây ăn mòn thiết bị và gây hại cho sức khỏe. Chuẩn bị Axit clohydric trong môi trường kín hoặc sử dụng thiết bị chịu áp lực nếu cần thiết.
3.4 Lưu trữ và thải bỏ:
Bảo quản Axit clohydric ở nơi khô ráo, thoáng mát, tránh tiếp xúc với không khí. Thải bỏ Axit clohydric cẩn thận theo quy định về xử lý chất thải hóa học.
3.5 Cẩn thận với các tác nhân khác:
Tránh tiếp xúc với các hóa chất khác như kim loại kiềm (ví dụ Na) hoặc chất nổ có thể gây phản ứng nguy hiểm.
Kết luận:
Để đảm bảo quá trình điều chế HCl diễn ra suôn sẻ và an toàn, ngoài việc nắm rõ kiến thức, bạn cũng cần tìm nhà cung cấp hóa chất uy tín, có nguồn gốc xuất xứ rõ ràng. Hiện nay Hóa chất Vũ Hoàng đã là địa chỉ mua hóa chất được nhiều khách hàng lựa chọn. Vũ Hoàng cam kết tất cả hóa chất họ cung cấp đều có nguồn gốc xuất xứ rõ ràng, đặc biệt được đảm bảo. an toàn chất lượng. Khi mua hóa chất tại đây bạn cũng sẽ nhận được sự hướng dẫn tận tình về cách pha chế HCl đảm bảo an toàn nhất.
Vì vậy các bạn cứ yên tâm mà mua nhé, đừng lo lắng gì cả.
Trên đây là những chia sẻ của Hóa chất Vũ Hoàng về cách điều chế HCl. Hy vọng nó sẽ giúp các bạn hiểu rõ hơn về quy trình điều chế Axit Clohydric trong thí nghiệm và trong công nghiệp.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn