Cách giải bài tập tính theo phương trình hóa học (cực hay, chi tiết) – Tổng hợp các dạng bài tập Hóa học lớp 8 với phương pháp giải chi tiết giúp bạn biết cách làm bài tập Hóa 8.-Cách giải bài tập tính theo phương trình hóa học (cực hay, chi tiết)
Cách giải bài tập tính theo phương trình hóa học (cực hay, chi tiết)
Bài viết Cách giải bài tập tính theo phương trình hóa học với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập
tính theo phương trình hóa học.
Cách giải bài tập tính theo phương trình hóa học (cực hay, chi tiết)
1. Tính khối lượng chất tham gia và chất sản phẩm
* Các bước giải:
Bước 1: Chuyển đổi số liệu đầu bài sang số mol.
– Bài cho khối lượng: n = 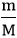 (mol)
(mol)
– Bài cho thể tích khí ở điều kiện tiêu chuẩn: n = 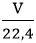 (mol)
(mol)
Bước 2: Lập phương trình hoá học.
Bước 3: Dựa vào số mol chất đã biết để tính số mol chất cần tìm theo Phương trình hóa học.
Bước 4: Tính khối lượng các chất cần tìm theo công thức: m = n . M
* Nếu phản ứng đã biết khối lượng của (n – 1) chất, cần tính khối lượng của 1 chất còn lại, ta có thể sử dụng định luật bảo toàn khối lượng
2. Tính thể tích khí tham gia và tạo thành
* Các bước giải:
Bước 1: Chuyển đổi số liệu đầu bài sang số mol.
– Bài cho khối lượng: n = 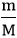 (mol)
(mol)
– Bài cho thể tích khí ở điều kiện tiêu chuẩn: n = 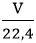 (mol)
(mol)
Bước 2: Viết Phương trình hóa học
Bước 3: Dựa vào phương trình phản ứng để tính số mol chất tham gia hoặc sản phẩm
Bước 4: Áp dụng công thức tính toán theo yêu cầu đề bài
V = n. 22,4 (lít) đối với khí đo ở điều kiện tiêu chuẩn
Ví dụ 1: Đốt cháy hoàn toàn 13 gam Zn trong khí oxi thu được ZnO.
a) Lập phương trình hóa học của phản ứng.
b) Tính khối lượng ZnO thu được?
Lời giải:
a) Phương trình hóa học: 2Zn + O2  2ZnO
2ZnO
b) Số mol Zn tham gia phản ứng là: nZn = 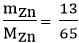 = 0,2 mol
= 0,2 mol
Phương trình hóa học: 2Zn + O2  2ZnO
2ZnO
Theo phương trình hóa học ta có:
2 mol Zn tham gia phản ứng thu được 2 mol ZnO
Vậy 0,2 mol Zn tham gia phản ứng thu được 0,2 mol ZnO
Khối lượng ZnO thu được là: mZnO = nZnO. MZnO = 0,2.(65+16) = 16,2 gam.
Ví dụ 2: Cacbon cháy trong khí oxi sinh ra khí carbon dioxide (CO2). Tính thể tích khí CO2 (đktc) sinh ra, nếu có 8 gam khí O2 tham gia phản ứng.
Lời giải:
Số mol O2 tham gia phản ứng là: nO2 = 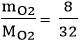 = 0,25 mol
= 0,25 mol
Phương trình hóa học: C + O2 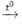 CO2
CO2
Theo phương trính hóa học ta có:
1 mol O2 tham gia phản ứng thu được 1 mol CO2
Vậy 0,25 mol O2 tham gia phản ứng thu được 0,25 mol CO2
Thể tích khí CO2 (đktc) sinh ra sau phản ứng là:
VCO2 = 22,4. nCO2 = 22,4.0,25 = 5,6 lít
Ví dụ 3: Đốt cháy hoàn toàn 27 gam Al trong khí oxi thu được Al2O3. Tính thể tích khí oxi (đktc) đã dùng trong phản ứng.
Lời giải:
Số mol Al tham gia phản ứng là: nAl = 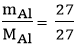 = 1 mol
= 1 mol
Phương trình hóa học: 4Al + 3O2 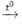 2Al2O3
2Al2O3
Theo phương trình hóa học: Đốt cháy 4 mol Al cần 3 mol O2
Vậy đốt cháy 1 mol Al cần 0,75 mol O2
Thể tích khí oxi (đktc) đã dùng trong phản ứng:
VO2 = 22,4.nO2 = 22,4.0,75 = 16,8 lít
Câu 1: Cho phương trình CaCO3 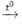 CO2 ↑+ CaO
CO2 ↑+ CaO
Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc)?
A. 7,84 lít.
B. 78,4 lít.
C. 15,68 lít.
D. 156,8 lít.
Lời giải:
Đáp án B
Phương trình hóa học:
CaCO3  CO2↑ + CaO
CO2↑ + CaO
1 → 1 mol
3,5 → 3,5 mol
Theo phương trình: nCO2 = nCaCO3 = 3,5 mol
Thể tích khí CO2 thu được là:
VCO2 = 22,4 . nCO2 = 22,4 . 3,5 = 78,4 lít
Câu 2: Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí sulfur dioxide có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí sulfur dioxide sinh ra.
A. 1,6 gam.
B. 3,2 gam.
C. 4,8 gam.
D. 6,4 gam.
Lời giải:
Đáp án B
Số mol S tham gia phản ứng là: nS = 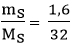 = 0,05 mol
= 0,05 mol
Phương trình hóa học:
S + O2  SO2
SO2
1 → 1 mol
0,05 → 0,05 (mol)
Theo phương trình hóa học, ta có: nSO2 = nS = 0,05 mol
Khối lượng khí sulfur dioxide sinh ra là:
mSO2 = nSO2. MSO2 = 0,05.64 = 3,2 gam
Câu 3: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là:
A. 21,6 gam
B. 16,2 gam
C. 18,0 gam
D. 27,0 gam
Lời giải:
Đáp án A
Số mol O2 tham gia phản ứng là: nO2 = 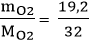 = 0,6 mol
= 0,6 mol
Phương trình hóa học:
4Al + 3O2  2Al2O3
2Al2O3
4 ← 3 mol
0,8 ← 0,6 (mol)
Theo phương trình: nAl = 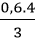 = 0,8 mol
= 0,8 mol
=> khối lượng Al phản ứng là: mAl = nAl.MAl = 0,8.27 = 21,6 gam
Câu 4: Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
A. 1,4 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 2,8 lít.
Lời giải:
Đáp án D
Số mol P tham gia phản ứng là: nP = 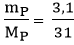 = 0,1 mol
= 0,1 mol
Phương trình hóa học:
4P + 5O2  2P2O5
2P2O5
4 → 5 mol
0,1 → 0,125 (mol)
Theo phương trình: nO2 = 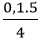 = 0,125 mol
= 0,125 mol
Thể tích của oxi (đktc) cần dùng là:
VO2 = 22,4.nO2 = 22,4 . 0,125 = 2,8 lít
Câu 5: Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí carbonic (CO2) và nước (H2O). Giá trị của V là:
A. 2,24 lít
B. 1,12 lít
C. 3,36 lít
D. 4,48 lít
Lời giải:
Đáp án A
Số mol CH4 tham gia phản ứng là: nCH4 = 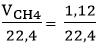 = 0,05 mol
= 0,05 mol
Phương trình hóa học:
CH4 + 2O2 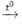 CO2 ↑ + 2H2O
CO2 ↑ + 2H2O
1 → 2 mol
0,05 → 0,1 (mol)
Theo phương trình: nO2 = 2nCH4 = 0,1 mol
Thể tích khí O2 cần dùng là:
VO2 = 22,4.nO2 = 22,4 . 0,1 = 2,24 lít
Câu 6: Cho phương trình CaCO3 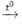 CO2 ↑+ CaO
CO2 ↑+ CaO
Để thu được 2,24 lít CO2 (đktc) thì số mol CaCO3 cần dùng là:
A. 1 mol
B. 0,1 mol
C. 0,001 mol
D. 2 mol
Lời giải:
Đáp án B
Số mol CO2 thu được là: nCO2 = 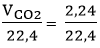 = 0,1 mol
= 0,1 mol
Phương trình hóa học:
CaCO3 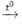 CO2 ↑+ CaO
CO2 ↑+ CaO
1 ← 1 mol
0,1← 0,1 (mol)
Theo phương trình: nCaCO3 = nCO2 = 0,1 mol
Câu 7: Cho 5,6 g sắt tác dụng hết với dung dịch hydrochloric acid loãng thu được FeCl2 và H2. Sau phản ứng thu được bao nhiêu lít khí H2 (đktc)
A. 2,24 lít
B. 22,4 lít
C. 1,12 lít
D. 3,36 lít
Lời giải:
Đáp án A
Số mol Fe tham gia phản ứng là: nFe = 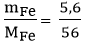 = 0,1 mol
= 0,1 mol
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2 ↑
1 → 1 mol
0,1 → 0,1 (mol)
Theo phương trình: nH2 = nFe = 0,1 mol
Thể tích khí H2 thu được sau phản ứng là:
VH2 = 22,4. nH2 = 22,4.0,1 = 2,24 lít
Câu 8: Khi nung nóng kali permangante (KMnO4) tạo thành Kali manganat (K2MnO4), mangan đioxit (MnO2) và khí oxi. Tính khối lượng KMnO4 cần lấy để điều chế được 3,36 lít khí oxi (đktc)?
A. 23,7 gam
B. 35,55 gam
C. 47,4 gam
D. 31,6 gam
Lời giải:
Đáp án C
Số mol O2 cần điều chế là: nO2 = 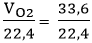 = 0,15 mol
= 0,15 mol
Phương trình hóa học:
2KMnO4 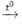 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
2 ← 1 mol
0,3 ← 0,15 (mol)
Theo phương trình: nKMnO4 = 2nO2 = 0,3 mol
Khối lượng KMnO4 cần dùng là:
mKMnO4 = nKMnO4 . MKMnO4 = 0,3.158 = 47,4 gam
Câu 9: Cho 6,72 lít khí C2H2 (đktc) phản ứng hết với khí oxi thu được khí carbonic và hơi nước. Thể tích khí oxi cần dùng (đktc) là:
A. 22,4 lít.
B. 13,44 lít.
C. 15,68 lít.
D. 16,8 lít.
Lời giải:
Đáp án D
Số mol C2H2 tham gia phản ứng là: nC2H2 = 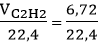 = 0,3 mol
= 0,3 mol
2C2H2 + 5O2 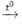 4CO2 ↑+ 2H2O
4CO2 ↑+ 2H2O
2 → 5 mol
0,3 → 0,75 (mol)
Theo phương trình: nO2 = 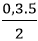 = 0,75 mol
= 0,75 mol
Thể tích khí oxi cần dùng (đktc) là:
VO2 = 22,4. nO2 = 22,4. 0,75 = 16,8 lít
Câu 10: Cho phương trình CaCO3  CO2↑ + CaO
CO2↑ + CaO
Để thu được 11,2 gam CaO cần dùng bao nhiêu mol CaCO3 ?
A. 0,1 mol.
B. 0,3 mol.
C. 0,2 mol.
D. 0,4 mol
Lời giải:
Đáp án C
Số mol CaO thu được là: nCaO = 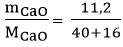 = 0,2 mol
= 0,2 mol
Phương trình hóa học:
CaCO3  CO2 + CaO
CO2 + CaO
1 ← 1 mol
0,2 ← 0,2 (mol)
Theo phương trình: nCaCO3 = nCaO = 0,2 mol
Xem thêm các dạng bài tập Hóa học lớp 8 có đáp án hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn