Nội dung bài viết
Cấu hình electron được sắp xếp và sắp xếp theo một trật tự nhất định. Hiểu cấu hình này sẽ giúp bạn xác định được đặc điểm và tính chất của một số hóa chất. Nội dung dưới đây Meraki Center sẽ chia sẻ chi tiết về vấn đề này, mời các bạn cùng khám phá.
1. Cấu hình electron là gì?
Cấu hình electron (cấu hình e) của nguyên tử thể hiện sự sắp xếp các electron theo một thứ tự nhất định. Sự sắp xếp này được thể hiện trên các lớp con của các lớp khác nhau.
Cấu hình electron là cấu hình điện tử nguyên tử, hiển thị một chuỗi biểu thị các quỹ đạo của electron. Thông qua cấu hình này, có thể xác định số lượng electron trong mỗi quỹ đạo và số lượng quỹ đạo điện tử trong nguyên tử.

Tìm hiểu cấu hình electron của nguyên tử
Ví dụ về cấu hình electron trong nguyên tử:
- Cấu hình electron sắt (Fe): 1s22s22p63s23p63d64s2
- Cấu hình electron kali (K): 1s22s22p63s23p64s1
- Canxi (Ca) có cấu hình electron là: 1s22s22p63s23p64s2
2. Khám phá trật tự các mức năng lượng trong nguyên tử
Các electron trong nguyên tử có cùng mức năng lượng nếu chúng ở cùng một lớp vỏ ở các quỹ đạo khác nhau. Sắp xếp các mức năng lượng nguyên tử theo thứ tự tăng dần. Cụ thể:
- Ở trạng thái cơ bản, năng lượng của electron trong nguyên tử dao động từ thấp đến cao.
- Nếu xảy ra hiện tượng nén năng lượng và điện tích hạt nhân tăng thì năng lượng 3d lớn hơn 4s.
- Từ trong ra ngoài, các lớp e sẽ có mức năng lượng tăng dần từ 1 – 7. Chúng được phân loại theo thứ tự s – p – d – f.
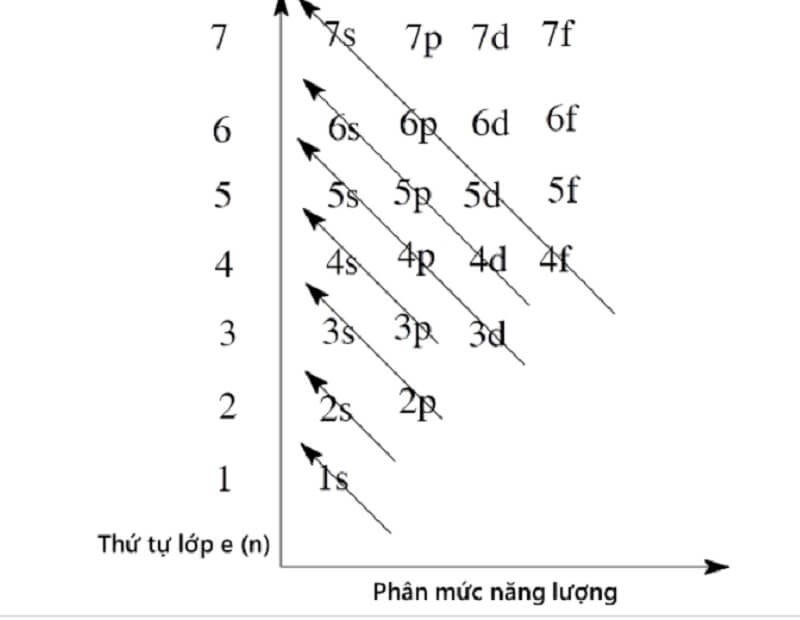
Khám phá thứ tự các mức năng lượng trong nguyên tử
3. Khám phá đặc điểm của lớp electron ngoài cùng là gì?
Mỗi nguyên tố sẽ thể hiện các tính chất hóa học độc đáo dựa trên cấu hình lớp vỏ electron ngoài cùng của nó. Trong đó:
Số electron ngoài cùng tối đa là 8e.
- Nguyên tử nào có lớp 1 – 3e ngoài cùng đều có tính chất nhường electron (trừ He, B và H). Những nguyên tử này rất ổn định nên chúng thường không tham gia vào các phản ứng hóa học.
- Các nguyên tử có số 4e ngoài cùng thường là nguyên tử phi kim hoặc nguyên tử kim loại.
- Các nguyên tử có lớp ngoài cùng 5 – 7e dễ dàng nhận electron và thường là phi kim.
- Các nguyên tử có 8 lớp electron ngoài cùng thường không tham gia phản ứng hóa học vì tính chất ổn định.
4. Cách viết cấu hình electron
Có một số nguyên tắc viết cấu hình electron. Các bước sau đây có thể được áp dụng để hiểu rõ hơn về vấn đề này.
4.1. Quy ước viết cấu hình electron nguyên tử là gì?
- Ký hiệu lớp thường là các chữ cái: s, p, d, f.
- Ký hiệu lớp e là: 1, 2, 3
- Trong lớp con, số lượng electron được biểu thị ở bên phải phía trên bằng số. Ví dụ: s2, d10…
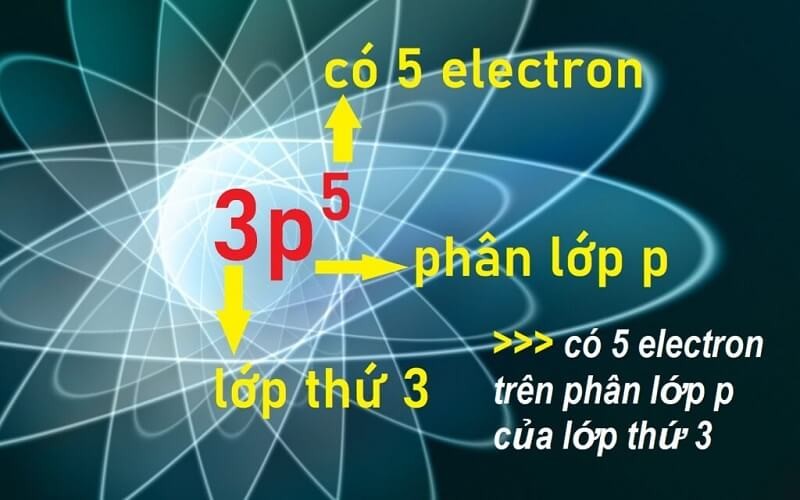
Cách viết cấu hình electron với quy ước cụ thể
4.2. Cách viết cấu hình electron?
Trước khi viết cấu hình electron, bạn cần xác định số electron có trong nguyên tử đó. Quy luật phân bố electron theo chiều tăng dần của năng lượng nguyên tử. Tuy nhiên, phân lớp s chỉ có thể chứa tối đa 2 electron, các phân lớp p, d và f lần lượt chứa tối đa 6 – 10 – 14e.
Ngoài ra, cách viết cấu hình electron còn phụ thuộc vào những nguyên tắc, quy luật sau:
- Nguyên lý ổn định: Mức năng lượng của electron nguyên tử dao động từ thấp đến cao khi ở trạng thái cơ bản.
- Nguyên lý Pauli: Mỗi quỹ đạo nguyên tử chỉ có tối đa 2 electron. Chúng quay quanh trục của mình nhưng theo các hướng khác nhau.
- Quy tắc Hund: Sự phân bố của các electron chưa ghép cặp trên quỹ đạo là tối đa trong cùng một lớp con. Tuy nhiên, hướng quay của chúng phải giống nhau.
4.3. Cách viết cấu hình electron
Cấu hình electron của nguyên tử được thể hiện theo thứ tự các lớp con trong lớp vỏ và lớp vỏ electron. Các mức năng lượng được phân bố theo thứ tự tăng dần. Đồng thời, mức năng lượng có thể được chèn vào.
Ví dụ: Nguyên tử sắt có Z = 26. Khi đó: Số electron trong sắt là 26.
Sự phân bố electron lúc này là 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Tuy nhiên, nhận ra rằng 4s < 3d, có sự chèn mức năng lượng.
cấu hình electron bằng sắt Lần này là 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Hoặc viết ngắn gọn Ar là nguyên tố Argon đứng ngay trước Fe là: [Ar] 3d6 4s2.
5. Cách viết cấu hình electron nguyên tử hiệu quả và nhanh chóng
Từ những kiến thức lý thuyết trên có thể áp dụng phương pháp viết cấu hình electron theo các bước dưới đây:
- Bước 1: Xác định chính xác số electron trong nguyên tử.
- Bước 2: Sắp xếp các electron theo quy tắc đã học. Chú ý, mức năng lượng của các electron tăng dần theo thứ tự: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
- Bước 3: Viết cấu hình cho từng lớp con.
Ví dụ: Viết cấu hình electron nguyên tử của nguyên tố Natri (Na) với Z = 11
Khi đó electron là 11. Các electron được sắp xếp theo thứ tự tăng dần như sau: 1s2 2s2 2p6 3s1.
→ Cấu hình e của Natri (Na) là 1s2 2s2 2p6 3s1.

Hướng dẫn chi tiết các bước viết cấu hình electron
6. Khi viết cấu hình electron cần lưu ý điều gì?
Khi viết cấu hình các bạn cần chú ý các vấn đề sau:
- Nắm vững các quy tắc và nguyên tắc về cách viết cấu hình.
- Chú ý nhận biết ký hiệu của từng lớp electron và lớp con.
- Xác định chính xác số electron nguyên tử.
Meraki Center đã phân tích chi tiết cấu hình electron và cách viết cấu hình electron đúng. Hy vọng những chia sẻ trên sẽ giúp các bạn có thêm thông tin để áp dụng vào các bài tập liên quan.


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn