Nội dung bài viết
Hydroxit lưỡng tính Đó là gì? Hiđroxit nào sau đây có tính chất lưỡng tính? Đây là 2 câu hỏi Meraki Center nhận được nhiều nhất trong những ngày luyện thi đại học vừa qua. Bài viết dưới đây sẽ giải thích chi tiết về Hydroxit lưỡng tính và các ví dụ thực tế để học sinh có thể vận dụng tốt nhất vào làm bài thi.
1. Định nghĩa Hydroxit lưỡng tính là gì?
1.1. Hydroxit là gì?
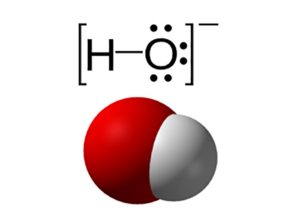
Hydroxide là tên của anion diatomic có ký hiệu OH-, được kết hợp bởi một nguyên tử oxy và một nguyên tử hydro. Các hợp chất vô cơ chứa nhóm OH- được gọi chung là hydroxit. Hầu hết các hợp chất chứa hydroxit đều thể hiện tính chất của bazơ.

Hydroxide được liên kết bởi một và một nguyên tử hydro
1.2. Hydroxit lưỡng tính là gì?
Hydroxit lưỡng tính là hydro, khi hòa tan trong nước, vừa có thể phân ly ở dạng bazơ vừa có thể phân ly ở dạng axit.
Ví dụ, Zn(OH)2 được gọi là Hydroxit lưỡng tính. Khi phân ly trong nước xảy ra hiện tượng sau:
- Phân ly dưới dạng axit: Zn(OH)2 Zn2+ + 2OH-
- Phân ly thành bazơ: Zn(OH)2 ZnO22- + 2H+

Zn(OH)2 là hiđroxit lưỡng tính
>>>XEM THÊM: : Phản ứng oxi hóa khử là gì?
: Phản ứng oxi hóa khử là gì?
2. Một số hiđroxit lưỡng tính
Trong hóa học, để biểu diễn tính chất lưỡng tính của Zn(OH)2, người ta sẽ viết công thức phân tử là H2ZnO2.
Một số loại Hydroxit lưỡng tính phổ biến là: Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2. Hydroxit lưỡng tính thường ít tan trong nước và có tính axit hoặc bazơ yếu.
Ví dụ: Al(OH)3
- Phân ly thành axit: Al(OH)3 Al3+ + 3OH-
- Phân ly dưới dạng bazơ: Al(OH)3 Al2O33- + 3H+

Sau khi thí nghiệm kết quả cho thấy một số Hydroxit lưỡng tính
3. Điện phân axit, bazơ trong nước
Ở trên chúng ta đã định nghĩa Hydroxide lưỡng tính là gì – Hydro khi hòa tan trong nước, vừa có thể phân ly dưới dạng bazơ mà còn phân ly dưới dạng axit. Tiếp theo ENGCHEM sẽ giải thích chi tiết cho các bạn quá trình điện phân axit, bazơ trong nước diễn ra như thế nào.
3.1. Điện phân axit trong nước
Theo lý thuyết Areniut, khi axit tan trong nước sẽ phân ly thành cation H+. Hầu hết các axit đều có một số tính chất chung và tất cả đều có tính chất của cation H+. Axit đa diện là axit phân ly nhiều lần tạo thành H+
Ví dụ:
HBr → H+ + Br–
CH3COOH ⇔ H+ + CH3COO–


Điện phân axit và bazơ trong nước
3.2. Điện phân bazơ trong nước
Theo lý thuyết Areniut, khi một bazơ tan trong nước sẽ phân ly tạo thành cation OH-. Hầu hết các dung dịch cơ bản đều có một số tính chất chung và tất cả đều có tính chất của OH-.
Ví dụ:
KOH → K+ + OH–
Ca(OH)2 → Ca2+ + 2OH–
4. Các loại bài tập Hydroxide lưỡng tính là gì?

Các dạng bài tập Hydroxit lưỡng tính
Bài tập 1: Viết phương trình điện phân của các chất sau:
a, Axit yếu: H2S, H2CO3
b, Bazơ mạnh: LiOH
c, Hydroxit lưỡng tính: Sn(OH)2
Giải pháp:
a, Phương trình điện phân axit yếu: H2S, H2CO3
H2S ⇔ H+ + HS–
HS– ⇔ H+ + S2-
H2CO3 ⇔ H+ + HCO3–
HCO3– ⇔ H+ +CO32-
b, Phương trình điện phân bazơ mạnh: LiOH
LiOH → Li+ + OH–
c, Phương trình điện phân của Hydroxit lưỡng tính: Sn(OH)2
– Độ phân ly axit: Sn(OH)2 ⇔ SnO22- + H+
– Độ phân ly bazơ: Sn(OH)2 ⇔ Sn2+ + 2OH–
Bài tập 2: Theo lý thuyết A-re-ni-ut, định nghĩa nào sau đây là đúng?
A. Hợp chất có thành phần phân tử là hydro là axit.
B. Hợp chất có thành phần phân tử có nhóm OH làm bazơ.
C. Hợp chất có khả năng phân ly thành cation H+ trong nước là axit.
Giải pháp: Đáp án C đúng
A sai vì: Axit phân ly trong nước tạo ra H+
B sai vì rượu có nhóm OH nhưng không phải là bazơ
Bài 3: Viết phương trình điện phân H3PO4 trong nước
Giải pháp:
H3PO4 là một axit ba bước:
H3PO4 ⇌ H+ + H2PO4–
H3PO4 – ⇌ H+ + HPO42-
H3PO4 2- ⇌ H+ + PO43-
Bài 4: Chất nào sau đây là hiđroxit lưỡng tính?
A. Mg(OH)2
B. Zn(OH)2
C. NaOH
D.Fe(OH)2
Giải pháp: Câu trả lời đúng là B
Zn(OH)2 là chất lưỡng tính, ngoài ra còn có một số loại hydroxit lưỡng tính khác: Al(OH)3, Sn(OH)2, Cr(OH)3, Pb(OH)2
Bài 5: Trong dung dịch HNO3, bỏ qua sự phân ly của nước, hãy xác định các phân tử của chất này.
A.H+, NO3-
B.H+, NO3-, H2O
C. H+, NO3-, HNO3
D.H+, NO3-, HNO3, H2O
Giải pháp: Đáp án B đúng
Ta có phương trình điện phân: HNO3 → H+ + NO3-
Bài 6: Chọn chất là hiđroxit lưỡng tính trong các chất sau:
A. Zn(OH)2, Cu(OH)2
B. Al(OH)3, Cr(OH)2
C. Sn(OH)2, Pb(OH)2
D. Cả A, B, C.
Giải pháp: Đáp án D đúng
Bài 7: Cho dãy ion dưới đây, hãy xác định dãy nào có tính chất lưỡng tính
A. Cl–, Na+, NH4+, H2O
B. ZnO, Al2O3, H2O
C. Cl–, Na+
D. NH4+, Cl–, H2O
Giải pháp: Đáp án B đúng
A sai vì Na+, Cl- là các ion trung tính; NH4+ là ion axit
C sai do Na+; Cl- đều là ion trung tính.
D sai vì NH4+ là ion axit; Cl- là ion trung tính.
Hy vọng với những thông tin về Hydroxit lưỡng tính là gì? Những điều trên sẽ giúp học sinh vận dụng hiệu quả để làm bài tập về nhà. Xem thêm các dạng bài tập trên website truongchuvananhue.edu.vn. Đừng quên chia sẻ bài viết nếu bạn thấy thú vị nhé.



Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn