Hóa học 9 Bài 3: Tính chất hóa học của axit – Lý thuyết Hóa 9 – Tổng hợp Lý thuyết Hóa học lớp 9 hay, chi tiết được biên soạn theo từng bài học giúp bạn học nắm vững kiến thức trọng tâm môn Hóa học lớp 9.-Hóa học 9 Bài 3: Tính chất hóa học của axit
Hóa học 9 Bài 3: Tính chất hóa học của axit
Bài viết Bài 3: Tính chất hóa học của axit hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm
Bài 3: Tính chất hóa học của axit.
Hóa học 9 Bài 3: Tính chất hóa học của axit
Bài giảng: Bài 3: Tính chất hóa học của axit – Cô Phạm Thu Huyền (Giáo viên Meraki Center)
1. Axit làm đổi màu chất chỉ thị màu
– Dung dịch axit làm đổi màu quỳ tím thành đỏ.
Ví dụ:
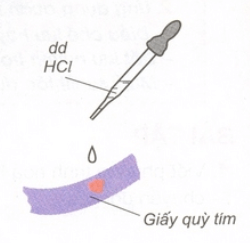
– Trong hóa học, quỳ tím là chất chỉ thị màu để nhận biết dung dịch axit.
2. Axit tác dụng với kim loại
– Dung dịch axit tác dụng được với nhiều kim loại tạo thành muối và giải phóng khí hiđro.
Ví dụ:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
2HCl + Fe → FeCl2 + H2 (↑)
– Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với HCl, H2SO4 loãng.
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng khí hiđro.
3. Axit tác dụng với bazơ: Axit + bazơ → muối + H2O
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
HCl + NaOH → NaCl + H2O
Phản ứng của axit với bazơ được gọi là phản ứng trung hòa.
4. Axit tác dụng với basic oxide: Axit + basic oxide → muối + H2O
Ví dụ:
6HCl + Fe2O3 → FeCl3 + 3H2O
H2SO4 + MgO → MgSO4 + H2O
Ngoài ra, axit còn tác dụng với muối.
Ví dụ:
MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O
Dựa vào tính chất hóa học, axit được phân làm 2 loại:
+ Axit mạnh như HCl, H2SO4, HNO3,…
+ Axit yếu như H2S, H2CO3,…
Xem thêm các bài Lý thuyết & Bài tập Hóa học lớp 9 có đáp án hay khác:
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn