Lý thuyết Phân loại các chất điện li (hay, chi tiết nhất) – Tổng hợp các dạng bài tập Hóa 11 với phương pháp giải chi tiết giúp bạn biết cách làm bài tập Hóa học 11.-Lý thuyết Phân loại các chất điện li (hay, chi tiết nhất)
Lý thuyết Phân loại các chất điện li (hay, chi tiết nhất)
Bài viết Lý thuyết Phân loại các chất điện li với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập
Lý thuyết Phân loại các chất điện li.
Lý thuyết Phân loại các chất điện li (hay, chi tiết nhất)
1. Độ điện li (α)
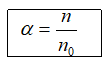 ĐK: 0 < α ≤ 1
ĐK: 0 < α ≤ 1
n: số phân tử hoà tan; n0: số phân tử ban đầu.
2. Chất điện li mạnh và chất điện li yếu
– Chất điện li mạnh: Là những chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion (α = 1, phương trình biểu diễn →).
Axit mạnh: HCl, HNO3, HClO4, H2SO4, HBr, HI, …
Bazơ mạnh: KOH, NaOH, Ba(OH)2, …
Muối: Hầu hết các muối (trừ HgCl2, Hg(CN)2 ).
– Chất điện li yếu: Là những chất khi tan trong nước, chỉ có một phần số phân tử hoà tan phân li ra ion (0 < α < 1, phương trình biểu diễn ⇋).
Axit yếu: CH3COOH, HClO, H2S, HF, H2SO3, H2CO3, …
Bazơ yếu: Mg(OH)2, Al(OH)3, NH3, …
– Cân bằng điện li:
Ví dụ: HF → H+ + F– 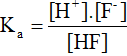
* Ảnh hưởng của sự pha trộn đến độ điện li α: Khi pha loãng → α tăng.
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi Tốt nghiệp THPT hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn