Mg(OH)2 + HCl → MgCl2 + H2O | Mg(OH)2 ra MgCl2 | HCl ra MgCl2 – Hướng dẫn cân bằng phản ứng hóa học của tất cả phương trình hóa học thường gặp giúp bạn học tốt môn Hóa.-Mg(OH)2 + HCl → MgCl2 + H2O | Mg(OH)2 ra MgCl2 | HCl ra MgCl2
Mg(OH)2 + HCl → MgCl2 + H2O | Mg(OH)2 ra MgCl2 | HCl ra MgCl2
Phản ứng Mg(OH)2 + HCl hay Mg(OH)2 ra MgCl2 hoặc HCl ra MgCl2 thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất.
Bên cạnh đó là một số bài tập có liên quan về Mg(OH)2 có lời giải, mời các bạn đón xem:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Điều kiện phản ứng
– Phản ứng xảy ra ngay điều kiện thường.
Cách thực hiện phản ứng
– Nhỏ từ từ HCl vào ống nghiệm chứa Mg(OH)2
Hiện tượng nhận biết phản ứng
– Mg(OH)2 tan dần tạo dung dịch.
Bạn có biết
– Các bazơ đều phản ứng với dung dịch axit tạo thành muối và nước.
Ví dụ 1:
Cho 0,01 mol Mg(OH)2 phản ứng vừa đủ với 100ml HCl aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 0,2.
Hướng dẫn giải:
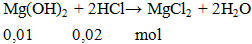
a = 0,02 : 0,1 = 0,2M.
Đáp án D.
Ví dụ 2:
Cần bao nhiêu ml HCl 1M để hòa tan hoàn toàn 5,8 gam Mg(OH)2?
A. 100 ml. B. 200 ml. C. 50 ml. D. 150 ml.
Hướng dẫn giải:
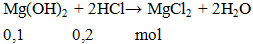
V = 0,2 : 1 = 0,2 lít = 200ml.
Đáp án B.
Ví dụ 3:
Cho 100ml HCl 0,1M phản ứng vừa đủ với Mg(OH)2 thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 0,745g. B. 0,475g. C. 0,585g. D. 7,54g.
Hướng dẫn giải:
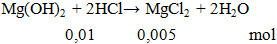
mmuối = 0,005.95 = 0.475 gam.
Đáp án B.
Xem thêm các phương trình hóa học hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn