NaOH + CO2 → NaHCO3 | NaOH + CO2 ra NaHCO3 (tỉ lệ 1:1) – Hướng dẫn cân bằng phản ứng hóa học của tất cả phương trình hóa học thường gặp giúp bạn học tốt môn Hóa.-NaOH + CO2 → NaHCO3 | NaOH + CO2 ra NaHCO3 (tỉ lệ 1:1)
NaOH + CO2 → NaHCO3 | NaOH + CO2 ra NaHCO3 (tỉ lệ 1:1)
Phản ứng NaOH + CO2 (tỉ lệ 1 : 1) ra NaHCO3 thuộc loại phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất.
Bên cạnh đó là một số bài tập có liên quan về NaOH có lời giải, mời các bạn đón xem:
NaOH + CO2 → NaHCO3
1. Phương trình phản ứng CO2 tác dụng với NaOH
CO2 + NaOH → NaHCO3
2. Cách tiến hành phản ứng CO2 tác dụng với NaOH
– Dẫn khí CO2 từ từ đến dư vào ống nghiệm chứa NaOH và vài giọt chất chỉ thị.
3. Cách viết phương trình ion thu gọn của phản ứng CO2 tác dụng với NaOH
Bước 1: Viết phương trình phân tử:
CO2 + NaOH → NaHCO3
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
CO2 + Na+ + OH– → Na+ + HCO3–
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
CO2 + OH– → HCO3–
4. Xác định sản phẩm của phản ứng CO2 tác dụng với NaOH
– CO2 phản ứng với NaOH chỉ thu được muối NaHCO3 khi T = nNaOHnCO2≤1.
– CO2 phản ứng với NaOH chỉ thu được muối Na2CO3 khi T = nNaOHnCO2≥2.
– CO2 phản ứng với NaOH thu được cả muối NaHCO3 và Na2CO3 khi 1< T =nNaOHnCO2< 2.
5. Mở rộng kiến thức về CO2
5.1. Cấu tạo phân tử
– Cấu tạo của CO2 là O = C = O.
– Phân tử CO2 có cấu tạo thẳng, không phân cực.
5.2. Tính chất vật lý
– Là chất khí không màu, nặng gấp 1,5 lần không khí.
– Tan ít trong nước.
– CO2 khi bị làm lạnh đột ngột chuyển sang trạng thái rắn, gọi là nước đá khô.
– Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
Lưu ý: Khi sử dụng đá khô phải đeo gang tay chống lạnh để tránh bị bỏng lạnh khi tiếp xúc với đá khô.
5.3. Tính chất hóa học
– Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
– CO2 là acidic oxide, khi tan trong nước tạo thành carbonic acid:
CO2 (k) + H2O (l) ⇄ H2CO3 (dd)
– Ngoài ra, CO2 còn tác dụng với basic oxide và dung dịch kiềm.
Thí dụ:
CaO + CO2 →to CaCO3
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
5.4. Điều chế
a. Trong phòng thí nghiệm
– CO2 được điều chế bằng cách cho dung dịch HCl tác dụng với đá vôi.
– Phương trình hóa học:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
b. Trong công nghiệp
– Khí CO2 được thu hồi từ quá trình đốt cháy hoàn toàn than để cung cấp năng lượng cho các quá trình sản xuất khác.
C + O2 →to CO2
– Ngoài ra, khí CO2 còn được thu hồi từ quá trình chuyển hóa khí thiên nhiên, các sản phẩm dầu mỏ; quá trình nung vôi; quá trình lên men rượu từ đường glucose.
CaCO3 →to CaO + CO2
C6H12O6 →len men 2CO2 + 2C2H5OH
6. Bài tập vận dụng liên quan
Câu 1:Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2, hiện tượng quan sát được là
A. có kết tủa, lượng kết tủa tăng dần, kết tủa không tan.
B. không có hiện tượng gì trong suốt quá trình thực hiện.
C. lúc đầu không thấy hiện tượng, sau đó có kết tủa xuất hiện.
D. có kết tủa, lượng kết tủa tăng dần, sau đó kết tủa tan.
Hướng dẫn giải:
Đáp án D
Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
Câu 2: “Nước đá khô” không nóng chảy mà dễ thăng hoa nên được dùng để tạo môi trường lạnh và khô, rất tiện cho việc bảo quản thực phẩm. “Nước đá khô” là
A. SO2 rắn.
B. CO2 rắn.
C. CO rắn.
D. H2O rắn.
Hướng dẫn giải:
Đáp án B
Nước đá khô là CO2 rắn.
Câu 3:Cho khí CO2 vào lượng dư dung dịch nào sau đây sẽ tạo kết tủa?
A.MgCl2.
B. Ca(OH)2.
C. Ca(HCO3)2.
D.NaOH.
Hướng dẫn giải:
Đáp ánB
A và C không phản ứng → loại.
D. CO2 + 2NaOHdư → Na2CO3 + H2O → loại.
B. CO2 + Ca(OH)2 dư → CaCO3↓ + H2O
Câu 4: Chất khí nào sau đây, được tạo ra từ bình chữa cháy và dùng để sản xuất thuốc giảm đau dạ dày?
A. CO2.
B. N2.
C. CO.
D. CH4.
Hướng dẫn giải:
Đáp án A
Chất khí được tạo ra từ bình chữa cháy là CO2.
Thuốc giảm đau dạ dày là NaHCO3.
NaOH + CO2 → NaHCO3.
Câu 5:Cho dãy các chất sau: CO2, CO, SiO2, NaHCO3, NH4Cl. Số chất trong dãy tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là:
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải:
Đáp án B
Các chất thỏa mãn là CO2, NaHCO3 và NH4Cl.
CO2 + 2NaOH → Na2CO3 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Chú ý: SiO2 chỉ phản ứng với dung NaOH đặc nóng hoặc NaOH nóng chảy.
Câu 6:Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
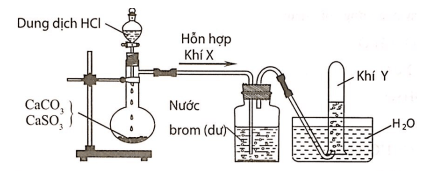
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
CaCO3→t0CaO+CO2
CaSO3→t0CaO+SO2
SO2+Br2+2H2O→2HBr+H2SO4
Câu 7:Sục 1,12 lít CO2 (đktc) vào 200ml dung dịch Ba(OH)2 0,2M. Khối lượng kết tủa thu được là:
A. 5,91g.
B. 19,7g.
C. 78,8g.
D. 98,5g.
Hướng dẫn giải:
Đáp án A
nCO2=0,05 mol;nBaOH2=0,04 mol1<nCO2nBaOH2=1,25<2
→ Tạo hỗn hợp 2 muối.
→nCO32−=nOH−−nCO2=0,04.2−0,05=0,03 mol
→n↓=0,03 mol→m↓=0,03.197=5,91 gam
Câu 8: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05M được kết tủa X và dung dịch Y. Khi đó khối lượng dung dịch Y so với khối lượng dung dịch Ca(OH)2 ban đầu sẽ là:
A. tăng 3,04g.
B. tăng 7,04g.
C. giảm 3,04g.
D. giảm 7,04g.
Hướng dẫn giải:
Đáp án A
nCO2=0,16 mol; nCa(OH)2=0,1 mol→1<nCO2nCa(OH)2=1,6<2
→ Dung dịch Y chỉ có muối Ca(HCO3)2 và kết tủa X là CaCO3
→n↓=nOH−−nCO2=0,1.2−0,16=0,04 mol
→m↓=0,04.100=4 gam
mCO2=0,16.44=7,04 gam>m↓
→ Dung dịch sau phản ứng tăng 3,04 gam.
Câu 9: Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500 ml dung dịch NaOH 0,16M thu được dung dịch X. Thêm 250 ml dung dịch Y gồm BaCl2 0,16M và Ba(OH)2 aM vào dung dịch X thu được 3,94g kết tủa và dung dịch Z. Giá trị của a là:
A. 0,015.
B. 0,02.
C. 0,03.
D. 0,04.
Hướng dẫn giải:
Đáp án B
nCO2=0,07 mol; nNaOH=0,08 mol; nBa(OH)2=0,25a molnBaCl2=0,04 mol; nBaCO3 ↓=0,02 mol
→∑nOH−=0,08+0,5a (mol)
Nhận thấy: n↓<nCO2<nBaCl2
→ Dung dịch Z chứa Na+:0,08 molHCO3−Cl−:0,08 molBa2+
Bảo toàn nguyên tố C:
nHCO3−=0,07−0,02=0,05 mol
→∑nOH−=2nCO2+nHCO3−→0,08+0,5a=0,09 →a=0,02 mol
Câu 10: Cho 8,96 lít CO2 (đktc) sục vào dung dịch chứa 100 ml dung dịch chứa hỗn hợp Ca(OH)2 2M và NaOH 1,5M thu được a gam kết tủa và dung dịch X. Đun nóng kĩ dung dịch X thu được thêm b gam kết tủa. Giá trị (a + b) là
A. 5 gam
B. 15 gam
C. 20 gam
D. 40 gam
Hướng dẫn giải:
Đáp ánC
Theo bài → dung dịch X gồm các ion Na+, Ca2+,HCO3−
nCO32−+nHCO3−=nCO2=8,9622,4=0,4 molnOH−=2nCO32−+nHCO3−=0,1.2.2+1,5=0,55 mol
⇒nCO32−=0,15 molnHCO3−=0,25 mol→ dung dịch XNa+:0,15 molHCO3−:0,25 molCa2+
Bảo toàn điện tích →nCa2+=0,05 mol
⇒a=100.0,15=15gb=100.0,05=5g⇒a+b=20
Câu 11: Hấp thụ toàn bộ 0,3 mol CO2 vào dung dịch chứa 0,25 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam?
A. tăng 13,2g.
B. tăng 20g.
C. giảm 6,8g.
D. giảm 16,8g.
Hướng dẫn giải:
Đáp án C
Ta có: 1<nCO2nCa(OH)2=1,2<2
→ Sau phản ứng thu được hai muối CaCO3 và Ca(HCO3)2
→nCaCO3=nOH−−nCO2=0,25.2−0,3=0,2 mol
mCO2=0,3.44=13,2 gamm↓=0,2.100=20 gam>mCO2
→ Khối lượng dung dịch sau phản ứng giảm 6,8 gam.
Câu 12: Cho 5,6 lít CO2 (đktc) đi qua 164ml dung dịch NaOH 20% (d = 1,22g/ml) thu được dung dịch X. Cô cạn dung dịch X thì thu được khối lượng chất rắn là:
A. 15,5g.
B. 26,5g.
C. 31g.
D. 46,5g.
Hướng dẫn giải:
Đáp án D
nNaOH=164.1,22.20%40=1 mol; nCO2=0,25 mol→nNaOHnCO2=4
→ NaOH dư
→ Chất rắn gồm NaOH dư và muối Na2CO3.
Bảo toàn nguyên tố C:
nNa2CO3=nCO2=0,25 mol
Bảo toàn nguyên tố Na:
nNaOH dư = 1 – 0,25.2 = 0,5 mol
→ mchất rắn = 0,25.106 + 0,5.40 = 46,5 gam
Câu 13:Cho 3,36 lít khí CO2 (đktc) vào dung dịch chứa 500 ml KOH 0,1M và Ba(OH)2 0,12M kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là
A. 2,55.
B. 3,94.
C. 1,97.
D. 4,925.
Hướng dẫn giải:
Đáp án B
nCO2=0,15 mol; nBa2+=0,06 mol; nOH−=0,17 mol→nCO32−=nOH−−nCO2=0,02 mol<nBa2+→n↓=0,02 mol→m↓=0,02.197=3,94 gam
Câu 14:Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Hướng dẫn giải:
Đáp án B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
nCO2=nCaCO3=10100=0,1 mol
→VCO2=0,1.22,4=2,24lít
Xem thêm các phương trình hóa học hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn