Nội dung bài viết
Axit bazơ là gì? Đây là thuật ngữ khá quen thuộc trong các môn hóa học và trong lĩnh vực nghiên cứu hóa học hay y tế. Tuy nhiên, không phải ai cũng có thể nhớ, hiểu và vận dụng tốt những kiến thức về axit. Trong bài viết này Vietchem sẽ giải thích chi tiết về axit bazơ và ứng dụng của chúng.
1. Axit bazơ là gì?
Axit là một trong những phân tử hóa học bao gồm các nguyên tử Hydro và các gốc axit. Vì vậy, để thu được gốc Axit, chúng ta chỉ cần tách nguyên tử Hydro ra khỏi phân tử hóa học.
Ảnh 1: Các gốc axit có thể được tìm thấy rất nhiều trong môi trường xung quanh chúng ta
Các gốc axit có thể được tìm thấy trong nhiều môi trường, thực vật, thực phẩm hàng ngày như trái cây chua, chanh,… Ngay cả nguồn nước chúng ta sử dụng hàng ngày nếu không được lọc. Cũng có thể chứa các gốc axit.
Các gốc axit cũng có trong nhiều loại đồ uống như bia, rượu, đồ uống có ga, rượu, thực phẩm béo,… Khi cơ thể dung nạp các đồ uống hoặc thực phẩm có tính axit hoặc chứa nhiều gốc axit về lâu dài sẽ gây ra nhiều vấn đề không tốt cho cơ thể. cơ thể, thậm chí có nguy cơ mắc bệnh.
2. Phân loại gốc axit là gì?
Dựa vào cấu trúc của chúng, người ta chia axit thành hai loại: axit có hydro và axit không có hydro:
2.1. Bazơ axit có hydro
Axit bazơ với hydro: -HSO4, =HPO4, -H2PO4
2.2. Các gốc axit không chứa hydro
Các gốc axit không có hydro: -Cl, -NO3, =SO4, PO4
Ngoài ra, người ta còn phân loại axit thành axit có oxy và axit không có oxy:
Gốc axit có oxi: -NO3, =SO4, PO4
Các gốc axit không chứa oxy: -Cl, -Br, -F, -I

Hình 2: Phân loại gốc axit dựa trên tính chất của chúng
Công thức và tên gọi của từng axit bazơ
|
Axit và gốc axit |
|||||||
|
KHÔNG |
Công thức axit |
Tên axit |
Thể tích axit (đơn vị) |
Công thức gốc axit |
Tên axit bazơ |
hóa trị |
Khối lượng axit bazơ (đơn vị) |
|
1 |
HCl |
Axit clohydric |
36,5 |
-Cl |
clorua |
TÔI |
35,5 |
|
2 |
HBr |
Axit hydrobromic |
81 |
-Anh |
Bromua |
TÔI |
80 |
|
3 |
HF |
Axit flohydric |
20 |
-F |
Florua |
TÔI |
19 |
|
4 |
CHÀO |
axit iothidric |
128 |
-TÔI |
Iodua |
TÔI |
127 |
|
5 |
HNO3 |
Axit nitric |
63 |
-NO3 |
nitrat |
TÔI |
62 |
|
6 |
HNO2 |
Axit nitric |
47 |
-NO2 |
Nitrit |
TÔI |
46 |
|
7 |
H2CO3 |
Axit cacbonic |
62 |
=CO3 |
cacbonat |
II |
60 |
|
-HCO3 |
Hiđrocacbonat |
TÔI |
61 |
||||
|
8 |
H2SO4 |
Axit sunfuric |
98 |
=SO4 |
sunfat |
II |
96 |
|
-HSO4 |
Hydro Sunfat |
TÔI |
97 |
||||
|
9 |
H2SO3 |
Axit sunfuric |
82 |
=SO3 |
sunfit |
II |
80 |
|
-HSO3 |
Hydro sunfua |
TÔI |
81 |
||||
|
10 |
H3PO4 |
Axit photphoric |
98 |
PO4 |
photphat |
III |
95 |
|
-H2PO4 |
Dihydro photphat |
TÔI |
97 |
||||
|
=HPO4 |
Hydro Photphat |
II |
96 |
||||
|
☰PO4 |
photphat |
III |
95 |
||||
|
11 |
H3PO3 |
Axit photphoric |
82 |
☰PO3 |
photphat |
III |
79 |
|
-H2PO3 |
Dihydrophotphit |
TÔI |
81 |
||||
|
=HPO3 |
Hydrophotphat |
II |
80 |
||||
|
12 |
H2SO3 |
Axit sunfite |
82 |
=SO3 |
sunfit |
II |
80 |
|
-HSO3 |
Hydro sunfit |
TÔI |
81 |
||||
|
13 |
H2CO3 |
Axit cacbonic |
62 |
=CO3 |
cacbonat |
II |
60 |
|
-HCO3 |
Hiđrocacbonat |
TÔI |
61 |
||||
|
14 |
H2S |
Axit sunfuric |
34 |
=S |
sunfua |
II |
32 |
|
-HS |
Hydro sunfua |
TÔI |
33 |
||||
|
15 |
H2SiO3 |
Axit silicic |
78 |
=SiO3 |
silicat |
II |
76 |
|
-HSiO3 |
Hydro silicat |
TÔI |
77 |
||||
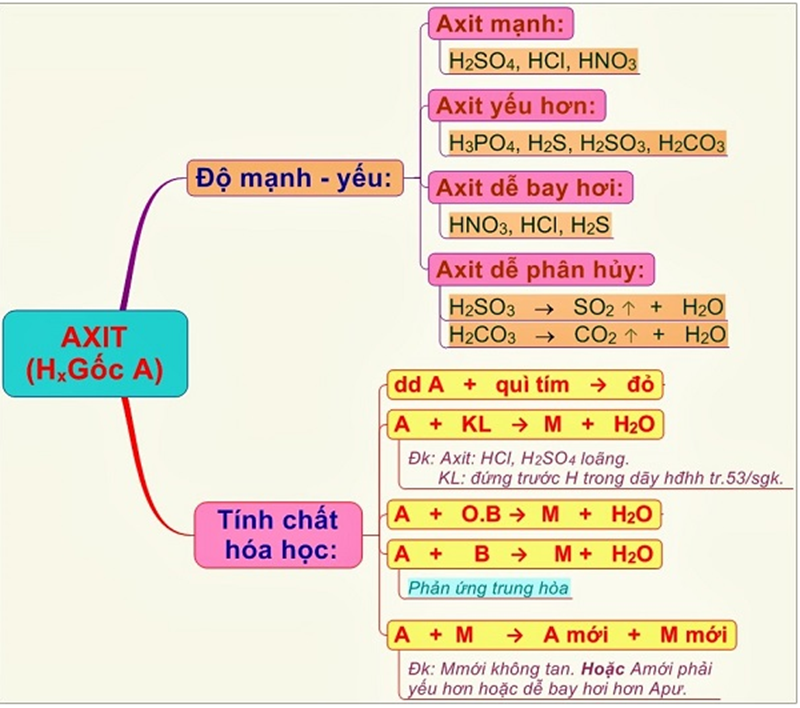
3. Tính chất hóa học của axit
Cùng tìm hiểu một số tính chất hóa học của Axit để hiểu rõ hơn về gốc axit:
3.1. Axit làm đổi màu giấy quỳ
Chúng tôi đã thực hiện một thí nghiệm bằng cách cho vài giọt dung dịch HCL vào giấy quỳ đỏ và quan sát thấy màu của nó chuyển sang màu đỏ. Do đó, ta có thể kết luận dung dịch axit làm đổi màu giấy quỳ đỏ thành màu đỏ.
Vì vậy, dựa vào tính chất này người ta dùng giấy quỳ tím để nhận biết dung dịch axit.
3.2. Axit tác dụng với kim loại
Khi dung dịch axit phản ứng với các kim loại đứng trước nguyên tử H trong chuỗi hoạt động hóa học, chúng ta sẽ thu được muối và giải phóng khí hydro. (Nếu Axit đậm đặc sẽ không giải phóng hydro).
Hình 3: Axit phản ứng với kim loại tạo ra phản ứng hóa học
3.3. Phản ứng với bazơ
Khi dung dịch Axit tác dụng với Bazơ thì phản ứng sẽ xảy ra rất mãnh liệt và ta sẽ thu được muối và nước. Đây được gọi là phản ứng trung hòa
3.4. Phản ứng với các oxit bazơ
Tất cả các axit đều phản ứng với các oxit bazơ tạo thành muối và nước
3.5. Tương tác với muối
- Khi axit tác dụng với muối sẽ xảy ra các trường hợp sau:
- Chất thu được có ít nhất một kết tủa hoặc một khí dễ bay hơi
- Sau phản ứng, nếu muối mới là muối tan thì axit phải yếu; nếu muối mới là muối không tan thì axit đó phải là axit mạnh.
4. Ứng dụng của một số axit
Hiện nay, ứng dụng của axit khá nhiều. Bạn có thể dễ dàng biết được ứng dụng của chúng trong lĩnh vực công nghiệp.
4.1. Lĩnh vực công nghiệp
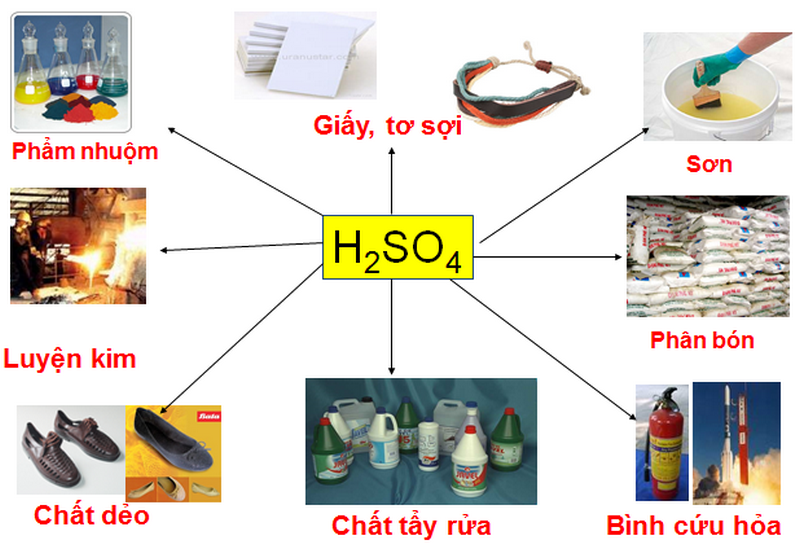
Axit được dùng để loại bỏ rỉ sét, làm sạch bề mặt trước khi hàn và làm chất điện phân trong ắc quy, ắc quy ô tô; Sản xuất phân bón, chất tẩy rửa, dầu mỏ, muối và axit, chất nổ, luyện kim, nhựa, tẩy trắng giấy,…
Hình 4: Axit được sử dụng rộng rãi trong lĩnh vực công nghiệp
4.2. Công nghệ thực phẩm
Axit thường được sử dụng: làm chất tạo màu, chất điều chỉnh độ axit, chất chống tạo bọt, chất chống vón cục, chất chống oxy hóa, chất tăng cường chất lượng, chất bảo quản màu, chất nhũ hóa, chất điều vị, chất điều vị và chất chế biến. Bột ngũ cốc xử lý, dưỡng ẩm, ổn định,…
4.3. lĩnh vực y tế
Aspirin là một loại thuốc có chứa axit dùng để hạ sốt được nghiên cứu từ cuối thế kỷ 19.
4.4. Trong cơ thể con người
Axit đóng vai trò cực kỳ quan trọng trong việc giúp tiêu hóa thức ăn bằng cách phá vỡ các phân tử thức ăn có cấu trúc phức tạp.
Axit amin cần thiết để tổng hợp protein cần thiết cho sự phát triển và sửa chữa các mô cơ thể.
Axit nucleic rất quan trọng trong việc sản xuất DNA và RNA và chuyển giao các đặc tính di truyền cho con cái. Axit cacbonic rất quan trọng để duy trì sự cân bằng độ pH trong cơ thể.
Như vậy các bạn vừa tìm hiểu về axit là gì và tính chất của chúng. Hiện nay, các doanh nghiệp ứng dụng axit bazơ rất nhiều để bảo quản thực phẩm và tạo ra các sản phẩm phục vụ cuộc sống. Hy vọng bạn hiểu thêm về gốc axit.



Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn