Silic (Chuyên đề Hóa học 11 chọn lọc) – Tuyển tập chuyên đề Hóa học 11 gồm phương pháp giải, bài tập tự luyện giúp bạn nắm được cách giải bài tập Hóa 11.-Silic
Silic
Chuyên đề Cacbon – Silic
Silic
I. Silic
1. Tính chất vật lý
– Silic có hai dạng thù hình: silic tinh thể và silic vô định hình.
2. Tính chất hóa học
– Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
– Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
a. Tính khử
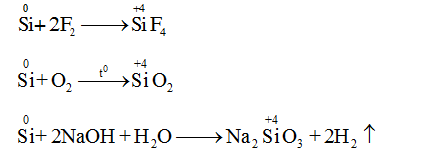
b. Tính oxi hóa
Mg + Si to→ Mg2Si
3. Điều chế
– Khử SiO2 ở nhiệt độ cao
SiO2 + 2Mg to Si + MgO
II. HỢP CHẤT CỦA SILIC
1. Silic đioxit
– SiO2 là chất ở dạng tinh thể.
– Tan chậm trong dung dịch kiềm đặc nóng, tan dể trong kiềm nóng chãy.
SiO2 + 2NaOH Na2SiO3 + H2O
– Tan được trong axit HF
SiO2 + 4HF → SiF4 + 2H2O
– Dựa vào tính chất này, người ta dùng dung dịch HF để khắc chử lên thủy tinh.
2. Axit silixic
– H2SiO3 là chất ở dạng keo, không tan trong nước. Khi mất một phần nước tạo thành vật liệu xốp là silicagen. Dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
– Axit silixic là axit yếu, yếu hơn cả axit cacbinic nên bị axit này đẩy ra khỏi dung dịch muối.
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
3. Muối silicat
– Đa số các muối silicat đều không tan, chỉ có muối silicat của kim loại kiềm tan được trong nước.
– Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng.
Xem thêm Chuyên đề Hóa học 11 hay khác:
Xem thêm các tài liệu học tốt lớp 11 hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn