Nội dung bài viết
Điện phân là quá trình tách các chất trong nước thành các ion âm và dương (còn gọi là anion và cation). Chất điện giải làm cho các dung dịch như muối, axit, bazơ dẫn điện. Nếu bạn quan tâm đến điện phân và chất điện giải hãy tìm hiểu chi tiết qua bài viết dưới đây của chúng tôi.
1. Điện phân là gì? Chất điện phân là gì?
Đây là quá trình phân ly của các chất trong nước hoặc khi các chất bị tan chảy. Sản phẩm của các phân tử chất điện phân hòa tan trong nước sau khi điện phân là cation (ion dương) và anion (ion âm). Gọi chung các ion này gọi là chất điện phân, chúng được tách ra khỏi các phân tử chất điện phân, có khả năng dẫn điện dung dịch. Vì vậy, nhiều người gọi dung dịch dẫn điện là chất điện giải nhưng chúng chỉ là hợp chất hóa học chứ không phải nguyên tố.

Điện phân là quá trình tách các chất trong nước hoặc các chất nóng chảy
2. Tính chất của chất điện giải
Để hiểu thêm về điện phân và chất điện giải, chúng ta phải lấy axit, bazơ và muối làm ví dụ. Axit, bazơ và muối đều là chất điện giải (hòa tan trong nước). Khi ở trong dung dịch, các hợp chất hóa học này sẽ phân ly (một phần hoặc hoàn toàn). Sau đó chúng trở thành các nguyên tử tích điện (hoặc nhóm nguyên tử) được gọi là ion. Các ion có khả năng chuyển động tự do trong dung dịch, trở thành hạt mang điện. Sau đây là quá trình điện phân một số hợp chất mà bạn nên biết:
- Axit → axit bazơ (ion âm) + H+.
- Bazơ → OH– (ion âm) + ion dương (kim loại).
- Muối → axit bazơ (ion âm) + ion dương (kim loại).
- Một số bazơ không chứa ion kim loại nhưng trong dung dịch phân ly thành ion (Anion, cation,…).
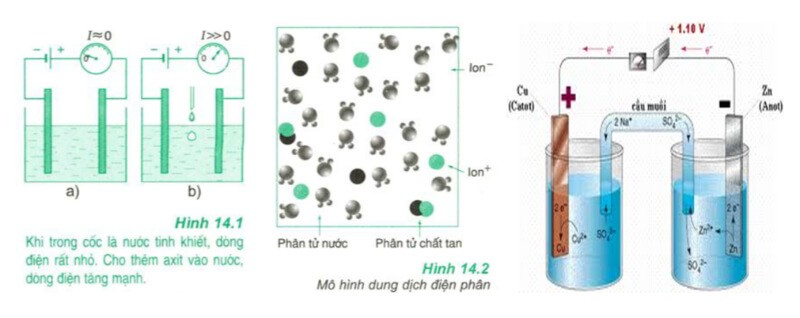
Tính chất của chất điện phân là phân ly (một phần hoặc hoàn toàn) rồi trở thành ion
3. Phân loại các chất điện giải thông dụng
Hiện nay, chất điện giải được chia làm 2 loại phổ biến nhất là chất điện ly mạnh và chất điện ly yếu. Cụ thể:
3.1. Chất điện ly mạnh
Chất điện ly mạnh sẽ tan hoàn toàn trong nước, các phân tử hòa tan sẽ phân ly thành ion. Nhóm này sẽ bao gồm các hợp chất axit mạnh, bazơ hòa tan và một số muối như:
- Axit mạnh: HBr, HI, HCl, HNO3, H2SO4, HClO4, HClO3…
- Bazơ hòa tan: Ba(OH)2, NaOH, KOH, Ca(OH)2,…
- Một số loại muối: CuSO4, NaCl, KNO3…
Phương trình điện phân của chất điện ly mạnh sẽ sử dụng mũi tên một chiều (→). Ví dụ:
- H2SO4 → 2H+ + SO4 (2-).
- KOH → K+ + OH-.
- Na2SO4 → 2Na+ + SO4 (2-).

Chất điện ly mạnh
3.2. chất điện li yếu
Chất điện ly yếu cũng tan trong nước nhưng chỉ một số ít phân tử hòa tan sẽ phân ly thành ion, số phân tử còn lại tồn tại trong dung dịch. Nhóm chất điện ly yếu sẽ bao gồm các axit trung bình và bazơ không tan như:
- Axit trung bình và yếu: HCOOH, H2S, H2CO3, H3PO4,…
- Bazơ không tan: Fe(OH)2, Fe(OH)3, Mg(OH)2,…
Phương trình điện phân của chất điện ly yếu sẽ sử dụng hai mũi tên ngược chiều nhau (⇌). Độ điện phân của một nhóm chất điện li yếu được đánh giá bằng đại lượng α. Ví dụ:
- H2S ⇌ H+ + HS-.
- α = Số phân tử phân ly hoặc tổng số phân tử hòa tan.

chất điện li yếu
4. Tổng hợp một số bài tập hóa học thông dụng về điện phân
Để giúp bạn hiểu rõ hơn về điện phân, dưới đây chúng tôi đã tổng hợp một số bài tập có chứa lời giải. Mời các bạn tham khảo để có cái nhìn tổng quát hơn về điện phân và chất điện giải. Cụ thể:
Bài tập 1
Trong “SGK Hóa học 11” trang 7 bài 1 nêu “Các dung dịch bazơ như NaOH, axit như HCl, muối như NaCl có thể dẫn điện. Vậy các dung dịch như sucrose, glycerol, rượu etylic không dẫn điện được, lý do chính là gì?
Hướng dẫn giải pháp
Trong dung dịch: Bazơ, muối, axit sẽ phân ly thành ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện. Ví dụ:
- HCl → H+ + Cl-.
- NaOH → Na+ + OH-.
- NaCl → Na+ + Cl-.
Các dung dịch như sucrose, glycerol và rượu etylic không dẫn điện vì trong dung dịch chúng không thể tách các ion dương và âm.
Bài tập 2
Trong “SGK Hóa học 11” trang 7 bài 3 nêu “Viết phương trình điện phân của một nhóm chất điện ly mạnh gồm: Ba(NO3)2 0,10M; HNO3 0,020M; KOH 0,010M.”
Hướng dẫn giải pháp
- Ba(NO3)2 → Ba 2+ + 2 NO3 −
0,10 0,10 0,20 ( M )
→ [Ba2+] = 0,1M; [NO3 −] = 0,2M
- HNO3 → H + + NO3 −
0,020 0,020 0,020 M
→ [H+] = [ NO3 − ] = 0,02M
- KOH → K + + OH −
0,010 0,010 0,010 triệu
→ [K+] = [OH-] = 0,010M
Bài tập 3
Trong “SGK Hóa học 11” trang 7 bài 5 nêu “Chất nào sau đây không dẫn điện?” Hãy khoanh tròn vào câu trả lời đúng:
- CaCl2 nóng chảy.
- HBr tan trong nước.
- NaOH nóng chảy.
- KCl rắn, khan.”
Hướng dẫn giải pháp:
Đáp án đúng cần khoanh tròn là đáp án D. Vì KCl là chất rắn và khan. Vì chúng tồn tại dưới dạng mạng tinh thể ion nên chúng rất ổn định. Các chất này sẽ không phân tách thành ion dương và ion âm (chuyển động tự do) khi ở trong dung dịch nên không dẫn điện.
Hy vọng sau khi đọc bài viết này các bạn đã hiểu rõ hơn về điện phân và chất điện giải. Hy vọng các bạn áp dụng những thông tin chia sẻ trong bài viết này để hoàn thành xuất sắc chương trình vật lý, hóa học bậc THPT của mình!


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn