Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất – Tổng hợp các dạng bài tập Hóa học 10 với phương pháp giải chi tiết giúp bạn biết cách làm bài tập Hóa 10.-Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Bài viết Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập
Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng.
Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Bài giảng: Bài 23: Hiđro clorua – hydrochloric acid và muối clorua – Cô Phạm Huyền (Giáo viên Meraki Center)
– Hiđro clorua (HCl) là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; Nặng hơn không khí.
1/ Tính chất vật lí
– Hiđro clorua (HCl) tan vào nước tạo thành dung dịch hydrochloric acid (HCl).
– Axit HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
2/ Tính chất hóa học
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
a/ Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
b/ Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 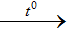 FeCl2 + H2
FeCl2 + H2
2Al + 6HCl 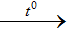 2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
c/ Tác dụng với basic oxide và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 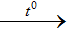 CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl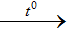 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
d/ Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 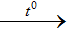 MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
3/ Điều chế
a/ Phương pháp sunfat: cho NaCl tinh thể vào dung dịch H2SO4 đậm đặc
2NaCltt + H2SO4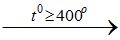 Na2 SO4 + 2HCl↑
Na2 SO4 + 2HCl↑
NaCltt + H2SO4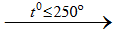 NaHSO4 + HCl↑
NaHSO4 + HCl↑
b/ Phương pháp tổng hợp: đốt hỗn hợp khí hidro và khí clo
H2 + Cl2 2HCl hidro clorua.
2HCl hidro clorua.
– Muối của hydrochloric acid được gọi là muối clorua. Chứa ion âm clorua (Cl–) và các ion dương kim loại, NH4+như NaCl, ZnCl2 CuCl2,AlCl3
– Công thức tổng quát: MCln.
– Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2 Cl2.
– Để nhận biết ion Cl–có thể dùng thuốc thử là dung dịch AgNO3 do tạo thành AgCl kết tủa trắng (AgCl tan trong dung dịch amonia do tạo phức với NH3):
AgNO3 + NaCl → AgCl + NaNO3
* Ứng dụng:
– NaCl dùng để ăn, sản xuất Cl2, NaOH, axit HCl
– KCl phân kali
– ZnCl2 tẩy gỉ khi hàn, chống mục gỗ.
– BaCl2 chất độc
– CaCl2 chất chống ẩm
– AlCl3 chất xúc tác
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT khác:
Lời giải bài tập lớp 10 sách mới:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn