Tính chất của carboxylic acid: tính chất hóa học, vật lí, danh pháp, điều chế chi tiết nhất – Tổng hợp các dạng bài tập Hóa 11 với phương pháp giải chi tiết giúp bạn biết cách làm bài tập Hóa học 11.-Tính chất của carboxylic acid: tính chất hóa học, vật lí, danh pháp, điều chế chi tiết nhất
Tính chất của carboxylic acid: tính chất hóa học, vật lí, danh pháp, điều chế chi tiết nhất
Bài viết Tính chất của carboxylic acid: tính chất hóa học, vật lí, danh pháp, điều chế với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập
Tính chất của carboxylic acid: tính chất hóa học, vật lí, danh pháp, điều chế.
Tính chất của carboxylic acid: tính chất hóa học, vật lí, danh pháp, điều chế chi tiết nhất
Bài giảng: Bài 45 : carboxylic acid – Cô Nguyễn Thị Nhàn (Giáo viên Meraki Center)
1. Định nghĩa, cấu tạo
– carboxylic acid là hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
– Nhóm 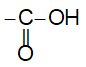 được gọi là nhóm cacboxyl, viết gọn là -COOH.
được gọi là nhóm cacboxyl, viết gọn là -COOH.
– Nhóm –OH và nhóm >C=O lại có ảnh hưởng qua lại lẫn nhau:
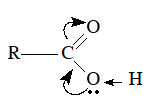
– Liên kết giữa H và O trong nhóm –OH phân cực mạnh, nguyên tử H linh động hơn trong ancol, anđehit và ketone có cùng số nguyên tử C.
2. Phân loại
– Nếu nhóm cacboxyl liên kết trực tiếp với nguyên tử hiđro hoặc gốc ankyl thì tạo thành dãy axit no, mạch hở, đơn chức, công thức chung là CnH2n+1COO, gọi là dãy đồng đẳng của formic acid (HCOOH). Ví dụ: CH3COOH (acetic acid), CH3CH2COOH (axit propionic), …
– Nếu gốc hydrocarbon trong phân tử axit có chứa liên kết đôi, liên kết ba thì gọi là axit không no. Ví dụ CH2=CH-COOH.
– Nếu gốc hydrocarbon là vòng thơm thì gọi là axit thơm, ví dụ C6H5-COOH (benzoic acid), …
– Nếu trong phân tử có nhiều nhóm cacboxyl (-COOH) thì gọi là axit đa chức. Ví dụ: HOOC-COOH (oxalic acid), HOOCCH2COOH (axit malonic), …
3. Danh pháp
– Tên thay thế:
Tên gọi = axit + tên hydrocarbon no tương ứng với mạch chính + “oic”.
VD:
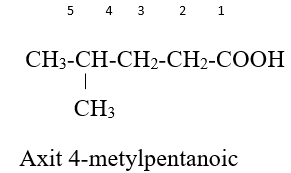
– Tên thông thường: Xuất phát từ nguồn gốc tìm ra chúng.
VD: HOOC-COOH: oxalic acid
HOOC-CH2-COOH: axit malonic.
HOOC-[CH2]4-COOH: axit ađipic.
Tên một số axit thường gặp
| Công thức | Tên thông thường | Tên thay thế |
|---|---|---|
| H-COOH CH3-COOH CH3CH2-COOH (CH3)2CH-COOH CH3 (CH2 )3-COOH CH2=CH-COOH CH2=C(CH3)-COOH HOOC-COOH C6H5-COOH | formic acid acetic acid Axit propionic Axit isobutiric Axit valeric Axit acrylic Axit metacrylic oxalic acid benzoic acid | Axit metanoic Axit etanoic Axit propanoic Axit 2-methylpropanoic Axit pentanoic Axit propenoic Axit 2-methylpropenoic Axit etanđioic benzoic acid |
– Ở ĐK thường các carboxylic acid đều là những chất lỏng hoặc rắn.
– Nhiệt độ sôi tăng theo chiều tăng M và cao hơn các ancol có cùng M: nguyên nhân là do giữa các phân tử carboxylic acid có liên kết hiđro bền hơn liên kết hidro giữa các phân tử ancol.
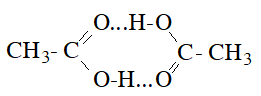
– carboxylic acid cũng tạo liên kết hiđro với nước và nhiều chất khác. Các formic acid, axetic, propionic tan vô hạn trong nước. Khi số nguyên tử C tăng lên thì độ tan trong nước giảm.
– Mỗi carboxylic acid có vị chua riêng biệt như acetic acid có vị chua giấm, axit xitric có vị chua chanh, oxalic acid có vị chua me, axit tactric có vị chua nho…
1. Tính axit và ảnh hưởng của nhóm thế
– Trong dung dịch, carboxylic acid phân li thuận nghịch:
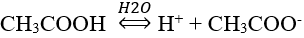
– Dung dịch carboxylic acid làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazơ, basic oxide tạo thành muối và nước:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
– Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
– Tác dụng với kim loại trước hiđro:
2CH3COOH + Zn → (CH3COO)2Zn + H2
2. Phản ứng tạo thành dẫn xuất axit
a. Phản ứng thế nhóm –OH: Phản ứng giữa axit và ancol được gọi là phản ứng ester hóa.
Chiều thuận là phản ứng ester hoá, chiều nghịch là phản ứng thuỷ phân ester.
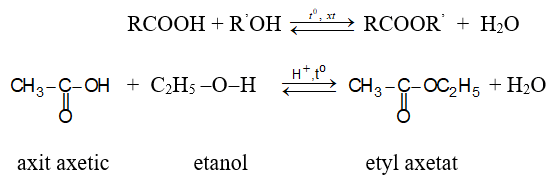
Phản ứng thuận nghịch, xúc tác H2SO4 đặc.
b. Phản ứng tách nước liên phân tử
Khi dùng xúc tác P2O5, hai phân tử axit tách đi một phân tử nước tạo thành phân tử anhiđrit axit.
Ví dụ:
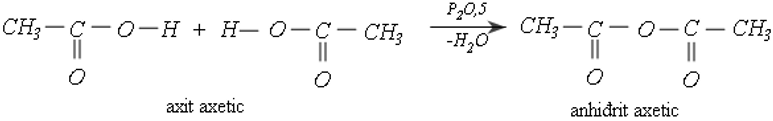
3. Phản ứng ở gốc hydrocarbon?/b>
a. Phản ứng thế ở gốc no
Khi dùng photpho (P) làm xúc tác, Cl chỉ thế cho H ở cacbon bên cạnh nhóm cacboxyl.

b. Phản ứng thế ở gốc thơm
Nhóm cacboxyl ở vòng benzene định hường cho phản ứng thế tiếp theo vào vị trí meta và làm cho phản ứng khó khăn hơn so với thế vào benzene:
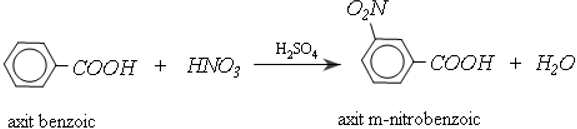
c. Phản ứng cộng vào gốc không no
Axit không no tham gia phản ứng cộng H2, Br2, Cl2, … như hydrocarbon không no.
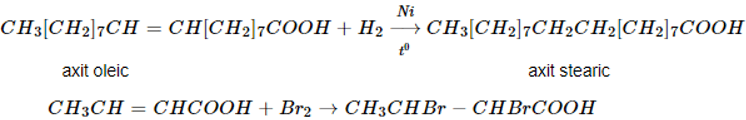
a. Điều chế
– Phương pháp lên men giấm:
C2H5OH + O2 → CH3COOH + H2O
– Oxi hóa aldehyde acetic:
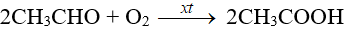
– Oxi hóa alkane:
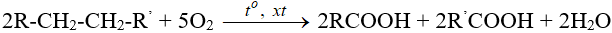
Ví dụ:
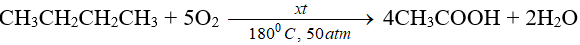
– Từ methanol:
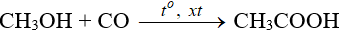
b. Ứng dụng
– acetic acid:
+ acetic acid được dùng để điều chế những chất có ứng dụng quan trọng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4-D; 2,4,5-T …), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi), một số ester (làm dược liệu, hương liệu, dung môi, …), Cellulose axetat (chế tơ axetat), …
– Các axit khác:
+ Các axit béo như axit panmitic (n-C15H31COOH), stearic acid (n-C17H35COOH), … được dùng để chế xà phòng. benzoic acid được dùng trong tổng hợp phẩm nhuộm, nông dược, … Axit salixylic dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau, …
+ Các axit đicacboxylic (như axit ađipic, axit phtalic, …) được dùng trong sản xuất poliamit, polieste để chế tơ sợi tổng hợp.
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi Tốt nghiệp THPT hay khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn