Tính chất hóa học của Bari (Ba) | Tính chất vật lí, nhận biết, điều chế, ứng dụng – Tổng hợp tính chất hóa học, tính chất vật lí, phản ứng hóa học, cách nhận biết, điều chế và ứng dụng của tất cả đơn chất, hợp chất hóa học.-Tính chất hóa học của Bari (Ba) | Tính chất vật lí, nhận biết, điều chế, ứng dụng
Tính chất hóa học của Bari (Ba) | Tính chất vật lí, nhận biết, điều chế, ứng dụng
Bài viết về tính chất hóa học của Bari (Ba) gồm đầy đủ thông tin cơ bản về Ba trong bảng tuần hoàn,
tính chất hóa học, tính chất vật lí, cách điều chế và ứng dụng.
Tính chất hóa học của Bari (Ba)
– Bari là kim loại kiềm thổ được Carl Scheele nhận biết lần đầu tiên vào năm 1774.
– Kí hiệu: Ba
– Cấu hình electron: [Xe] 6s1
– Số hiệu nguyên tử: 56
– Khối lượng nguyên tử: 137 g/mol
– Vị trí trong bảng tuần hoàn
+ Ô: số 56
+ Nhóm: IIA
+ Chu kì: 6
– Đồng vị: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba
– Độ âm điện: 0,89
1. Tính chất vật lí:
– Bari là kim loại kiềm thổ màu trắng bạc, dẻo, rèn được.
– Có khối lượng riêng là 3,6 g/cm3; có nhiệt độ nóng chảy là 7270C và sôi ở 18600C.
2. Nhận biết
– Đốt cháy các hợp chất của Bari, cho ngọn lửa màu đỏ son.
– Bari là kim loại kiềm thổ có tính khử mạnh.
Ba → Ba2+ + 2e
a. Tác dụng với phi kim (oxi, halogen….)
2Ba + O2 → 2BaO
Ba + Cl2 →BaCl2
b. Tác dụng với axit
– Với dung dịch axit HCl:
Ba + 2HCl → BaCl2 + H2
– Với dung dịch HNO3:
Ba + 4HNO3 đặc → Ba(NO3)2 + 2NO2 + 2H2O.
Lưu ý: Kim loại Ba dễ dàng phản ứng với hầu hết axit, với ngoại lệ là axit sunfuric, phản ứng dừng lại khi tạo thành lớp muối không tan trên bề mặt là bari sulfat.
c. Tác dụng với nước
– Ở nhiệt độ thường, Ba khử nước mãnh liệt.
Ba + 2H2O → Ba(OH)2 + H2
– Bari trong tự nhiên là hỗn hợp của 7 đồng vị bền, đồng vị phổ biến nhất là 138Ba (71,7 %).
– Bari chiếm 0,0425% trong vỏ Trái Đất và 13 µg/L trong nước biển. Nó có mặt trong các khoáng barit (ở dạng sulphat) và witherit (ở dạng carbonate).
– Bari được sản xuất thương mại bằng phương pháp điện phân nóng chảy bari clorua (BaCl2).
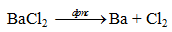
– Ba còn được điều chế bằng cách trộn barium oxide với bột nhôm nghiền mịn ở nhiệt độ giữa 1100 và 1200 °C
3BaO + 2 Al → 3Ba + Al2O3
– Bari được sử dụng chủ yếu trong sản xuất buji, ống chân không, pháo hoa và bóng đèn huỳnh quang.
+ Hợp chất bari sulfat có màu trắng và được sử dụng trong sản xuất sơn, trong chẩn đoán bằng tia X, và trong sản xuất thủy tinh.
+ Bari carbonate được dùng làm bả chuột và có thể được sử dụng trong sản xuất thủy tinh và gạch.
+ Bari nitrate và bari clorua được sử dụng để tạo màu xanh lá cây trong sản xuất pháo hoa.
+ Bari sulfua không tinh khiết phát lân quang sau khi đặt dưới ánh sáng.
+ Các muối của bari, đặc biệt là bari sulfat, có khi cũng được sử dụng để uống hoặc bơm vào ruột bệnh nhân, để làm tăng độ tương phản của những tấm phim X quang trong việc chẩn đoán hệ tiêu hóa.
– Bari peoxit: Ba2O2
– Bari clorua: BaCl2
– Bari sunfat: BaSO4
– Bari carbonate: BaCO3
– Bari nitrate: Ba(NO3)2
Xem thêm tính chất hóa học của các chất khác:


Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn