Nội dung bài viết
Tính chất hóa học của kim loại được thể hiện rõ ràng khi phản ứng với phi kim và dung dịch axit. Kim loại kiềm và Kim loại Đất sẽ có tính chất và phản ứng hóa học khác nhau. Hãy cùng Meraki Center tìm hiểu các tính chất hóa học cụ thể của kim loại khi xảy ra phản ứng qua bài viết sau.
Kim loại là gì?
Kim loại là chất rắn có khả năng dẫn nhiệt và dẫn điện. Chúng được tạo thành từ các nguyên tố hóa học có khả năng tạo ra các ion dương và liên kết kim loại. Sự khác biệt giữa các loại kim loại có thể được phân biệt dựa trên mức độ ion hóa của chúng. Trong bảng tuần hoàn các nguyên tố hóa học, khoảng 80% là kim loại, 20% còn lại là phi kim và á kim.

Kim loại là chất rắn có khả năng dẫn nhiệt và dẫn điện
Kim loại thường nằm ở nhóm IA (trừ H), IIIA (trừ Boron), IIA và một số nguyên tố thuộc nhóm IVA, VA và VIA. Ngoài ra, chúng còn xuất hiện ở nhóm B, từ nhóm IB đến nhóm VIIIB. Ví dụ về các kim loại phổ biến bao gồm: Nhôm (Al), đồng (Cu), sắt (Fe), vàng (Au), kẽm (Zn), bạc (Ag), v.v.
Tính chất hóa học của kim loại
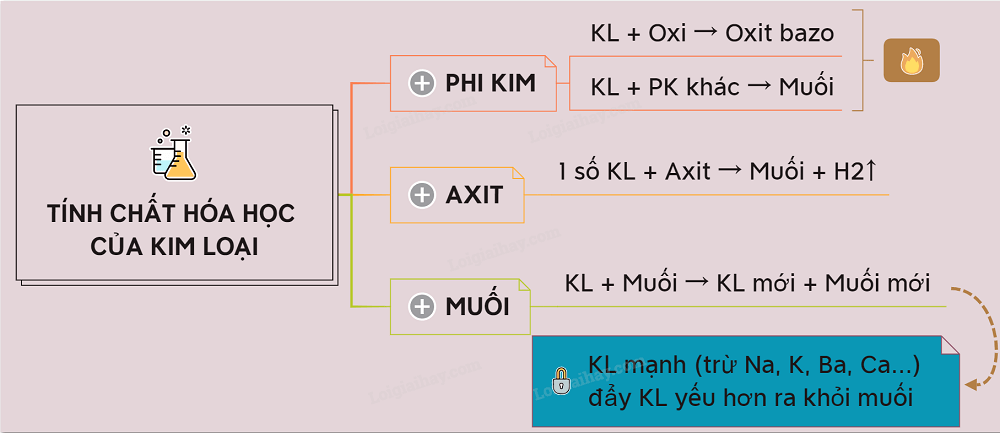
Tính chất hóa học của kim loại được thể hiện rõ ràng khi phản ứng với phi kim và dung dịch axit. Cụ thể:
Phản ứng của kim loại với phi kim
Tính chất hóa học của kim loại khi tác dụng với oxi:
- Trong môi trường có oxy, khi nung nóng đỏ sắt sẽ cháy và tạo thành oxit sắt (Fe2O3).
- Nhiều phi kim loại khác như nhôm (Al), kẽm (Zn), đồng (Cu),… cũng phản ứng với oxy tạo thành các oxit tương ứng như: Al2O3, ZnO, CuO,…
Tính chất hóa học của kim loại
Tương tác với các phi kim khác:
- Natri khi tan trong môi trường khí clo sẽ cháy và tạo ra khói trắng.
- Ở nhiệt độ cao, các kim loại như đồng, magie, sắt… có thể phản ứng với lưu huỳnh tạo thành các muối sunfua như CuS, MgS, FeS…
- Hầu hết các kim loại (trừ bạch kim như bạch kim, vàng, platina…) đều có thể phản ứng với oxy ở nhiệt độ bình thường hoặc cao, tạo thành các oxit (thường là oxit kiềm). Ở nhiệt độ cao, kim loại có thể phản ứng với nhiều phi kim khác tạo thành muối.
Tính chất hóa học của kim loại khi phản ứng với dung dịch axit
Các kim loại khác nhau có khả năng phản ứng với dung dịch axit (như axit sunfuric loãng, axit clohiđric…) để tạo thành muối và thải ra khí hydro. Ví dụ:
Zn(r)+H2SO4(dd)→ZnSO4 (dd)+ H2(k)
Phản ứng của kim loại với dung dịch muối
Tính chất hóa học của các kim loại khác nhau có khả năng phản ứng với dung dịch muối của kim loại khác để đẩy chúng ra khỏi dung dịch, tạo ra muối mới, kim loại mới.
Phản ứng của đồng với dung dịch bạc nitrat, dẫn đến đồng đẩy bạc ra khỏi muối, cho thấy đồng có hoạt tính hóa học mạnh hơn bạc.
Tính chất hóa học của kim loại
- Cu(r)+ 2AgNO3 (dd)→ Cu(NO3)2 (dd) + 2Ag(r)
Kẽm cũng có khả năng thay thế đồng khỏi dung dịch đồng(II) sunfat, dẫn đến bằng chứng về hoạt tính hóa học của kẽm cao hơn so với đồng:
- Zn(r) + CuSO4(dd) → ZnSO4(dd) + Cu(r)
Các kim loại như magie (Mg), nhôm (Al), kẽm (Zn)… cũng có thể phản ứng với dung dịch muối của đồng (CuSO4) hoặc bạc (AgNO3) để tạo thành muối của chúng và giải phóng kim loại tương ứng.
Kết luận: Nhiều kim loại có hoạt tính hóa học hơn (trừ natri, kali, canxi…) có thể đẩy các kim loại có hoạt tính hóa học yếu hơn ra khỏi dung dịch muối, tạo ra muối mới và kim loại mới.
Tính chất hóa học của kim loại kiềm
Các kim loại kiềm bao gồm sáu nguyên tố hóa học theo sau các nguyên tố khí hiếm: lithium (Li), natri (Na), kali (K), rubidium (Rb), Caesium (Cs) và francium (Fr).
Chúng thuộc nhóm IA trong bảng tuần hoàn các nguyên tố hóa học và thường đứng ở đầu mỗi chu kỳ (trừ chu kỳ I).
Các nguyên tử kim loại kiềm đều có năng lượng ion hóa thấp I1 và thế điện cực chuẩn rất âm E0 nên chúng có tính khử mạnh.

Tính chất hóa học của kim loại kiềm
Kim loại kiềm khi tác dụng với phi kim
- Hầu hết các kim loại kiềm đều có khả năng khử phi kim.
- Ví dụ, kim loại natri (Na) cháy trong môi trường oxy khô để tạo ra natri peroxit (Na2O2). Trong các hợp chất peroxit, oxy có số oxi hóa là -1.
Kim loại kiềm tác dụng với axit
Kim loại kiềm có thể dễ dàng khử ion H+ của dung dịch axit (như HCl, H2SO4 loãng) thành khí H2, gây phản ứng nổ nguy hiểm:
- 2Li + 2HCl → 2LiCl + H2↑
Phản ứng chung:
- 2M + 2H+ → 2M+ + H2↑
Phản ứng với nước
Kim loại kiềm dễ bị khử nước, giải phóng khí hydro
- 2Na + 2H2O → 2NaOH (dd) + H2↑
Phản ứng chung:
- 2M + 2H2O → 2MOH (dd) + H2↑
Vì vậy, kim loại kiềm thường được bảo quản bằng cách ngâm trong dầu hoặc dầu hỏa.
Tính chất hóa học của kim loại kiềm thổ
Kim loại kiềm thổ thuộc nhóm IIA trong bảng tuần hoàn. Trong một chu trình, chúng đứng sau các kim loại kiềm. Danh sách các kim loại kiềm thổ bao gồm: Beryllium (Be), Magiê (Mg), Canxi (Ca), Strontium (Sr), Barium (Ba) và Radium (Ra). Lưu ý: Radium là nguyên tố phóng xạ không ổn định.
Kim loại nhóm IIA có tính khử mạnh tuy nhiên yếu hơn kim loại kiềm. Trong các hợp chất của chúng, chúng thường có số oxi hóa +2.
Độ khử tăng dần từ Be đến Ra: M – 2e → M2+
Kim loại kiềm thổ khi phản ứng với phi kim
Trong điều kiện bình thường, berili (Be) và magie (Mg) bị oxy hóa chậm tạo thành màng oxit bảo vệ, trong khi các kim loại còn lại có tác dụng mạnh hơn.
Khi đun nóng, tất cả các kim loại nhóm IIA đều cháy thành oxit:
- 2M + O2 → 2MO
Ví dụ: 2Ca + O2 → 2CaO
Với halogen: phản ứng dễ dàng ở nhiệt độ phòng
- M + X2 → MX2
Ví dụ: Mg + Cl2 → MgCl2

Tính chất hóa học của kim loại kiềm thổ
Kim loại kiềm thổ tác dụng với nước H2O
Canxi (Ca), Stronti (Sr), Bari (Ba) phản ứng với nước ở nhiệt độ thường tạo ra dung dịch bazơ:
- Ca + 2H2O → Ca(OH)2 + H2↑
Magie (Mg) không tan trong nước lạnh mà tan chậm trong nước nóng tạo thành MgO.
- Mg + H2O → MgO + H2↑
Beryllium (Be) không hòa tan trong nước ngay cả ở nhiệt độ cao vì có lớp oxit bảo vệ. Nhưng Be có thể tan trong dung dịch kiềm mạnh hoặc kiềm nóng chảy tạo thành berylat:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- Tan chảy Be + 2NaOH → Na2BeO2 + H2
ENGCHEM vừa chia sẻ tính chất hóa học của các kim loại thông thường cũng như kim loại kiềm và kim loại đất với các bạn qua bài viết. Hy vọng bài viết của Meraki Center đã mang lại những thông tin hữu ích.



Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn