Nội dung bài viết
Muối là một trong những hợp chất quan trọng trong hóa học nên chúng ta phải hiểu rõ về hợp chất này cũng như các tính chất hóa học và thông tin cấu trúc của nó để ứng dụng tốt nhất vào thực tế. Và tất cả những kiến thức bạn cần tìm đều có trong bài viết dưới đây, mời các bạn đọc nhé.
1. Khái niệm về muối
Theo định nghĩa hóa học, muối là một chất hóa học bao gồm sự kết hợp ion của anion và cation. Muối chứa lượng anion (ion tích điện âm) và cation (ion tích điện dương) có liên quan để trung hòa các sản phẩm (không có điện tích ròng). Các ion thành phần này có thể là hữu cơ và vô cơ và tồn tại ở dạng đa nguyên tử hoặc nguyên tử.
Nói về thành phần của muối, đây là danh từ chung để chỉ các hợp chất hóa học gồm hai thành phần chính: amoni NH4+ kết hợp với các nguyên tử axit hoặc kim loại. Do khác nhau về thành phần nên tên gọi của từng loại muối không trùng nhau.
Muối có công thức đặt tên như sau: Tên kim loại + tên bazơ axit = Tên muối. Lưu ý, nếu kim loại có nhiều hóa trị thì phải dùng hóa trị kèm theo).
2. Các loại mong muốn phổ biến
Trước khi tìm hiểu về tính chất hóa học của muối photphat, chúng ta có thể chia muối thành hai loại cụ thể dựa trên thành phần hóa học của hợp chất này.
- Muối trung tính: Trong bazơ axit không chứa nguyên tử H nên có thể dùng nguyên tử kim loại thay thế. Một số muối tiêu biểu như CaCO3,… Na2CO3,….
- Muối axit: Cấu trúc bazơ axit tạo thành muối chứa nguyên tử H nên không thể dùng kim loại thay thế. Ví dụ K2HPO4, NaHSO4,….
Lưu ý: Trong tính chất hóa học của muối axit, số nguyên tử H đã được thay thế bằng nguyên tử kim loại, sẽ trùng với hóa trị của gốc axit.
Hình 1: Tổng quan về muối
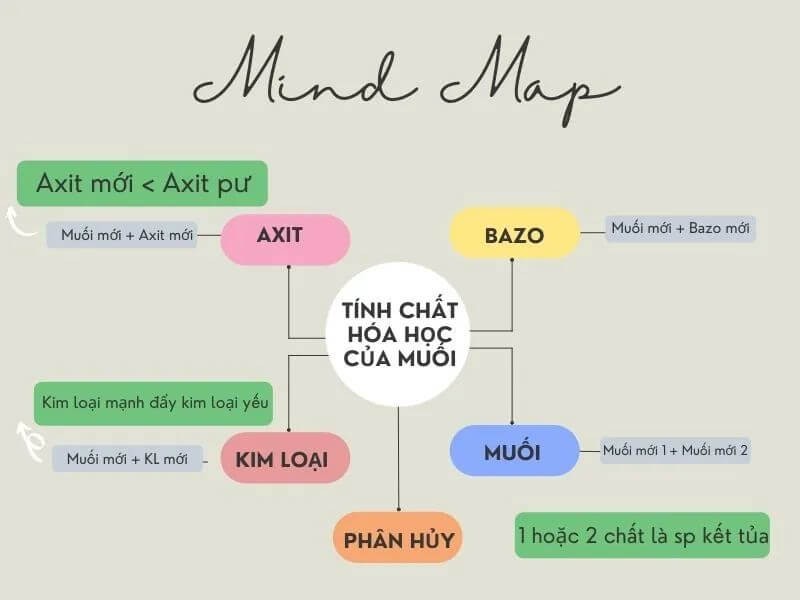
3. Tính chất hóa học chi tiết nhất của muối
Tìm hiểu về tính chất hóa học của muối, ta có các dạng sau:
3.1. Đổi màu quỳ đỏ bằng muối
Về tính chất hóa học của muối, muối có tính axit mạnh hơn nên có thể làm đổi màu quỳ tím thành đỏ. Trường hợp tính bazơ của muối mạnh hơn thì màu quỳ tím sẽ chuyển từ tím sang xanh. Trường hợp tính chất hóa học của muối aluminat trung tính thì quỳ tím vẫn giữ được màu.
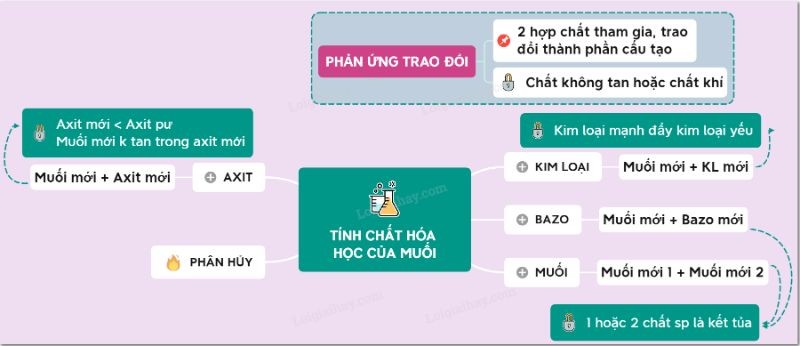
3.2. Phản ứng của muối với kim loại
Công thức tính chất hóa học của muối cacbonat: Muối + kim loại sẽ tạo thành muối mới + kim loại mới.
Fe + CuSO4 → FeSO4 + Cu
Chỉ trong điều kiện kim loại tham gia mạnh hơn kim loại vào tính chất hóa học của muối nahco3 thì phản ứng này mới xảy ra (không bao gồm các kim loại tan trong nước như Li, Na, K, Ba, Ca).
3.3. Tác dụng của muối đối với axit
Công thức hóa học của muối amoni: Muối + axit sẽ tạo thành muối mới + axit mới.
HCl + 2 AgNO3 → AgCl + HNO3
Giữa muối và axit sẽ xảy ra các điều kiện phản ứng sau: Muối tạo thành sẽ không tan hoặc axit tạo thành rất dễ bay hơi.
3.4. Tác dụng của muối đối với bazơ
Tính chất hóa học của muối với bazơ: Muối + bazơ sẽ tạo thành muối mới + bazơ mới
2KOH + CuCl2 → 2KCl + Cu(OH)2
Điều kiện là phải có chất không tan sau phản ứng.
3.5. Tác dụng của muối đối với muối
Công thức hóa học của muối nitrat: Muối + muối sẽ tạo thành 2 muối mới.
NaCl + AgNO3 → NaNO3 + AgCl
Tính chất hóa học của muối và điều kiện để muối và muối phản ứng bao gồm:
- Hai muối ban đầu phải được hòa tan
- Không hòa tan một trong hai muối tạo thành.
Phản ứng nhiệt
Sau bài giảng về tính chất hóa học của muối, các em sẽ thấy ở nhiệt độ cao một số loại muối sẽ bị nhiệt phân hủy.
CaCO3 -> CaO + CO2

Hình 2: Tính chất hóa học của muối
3.6. Phản ứng trao đổi
Bằng cách kiểm tra tính chất hóa học của muối, chúng ta sẽ biết được phản ứng trao đổi, nghĩa là khi tham gia phản ứng, hai hợp chất sẽ trao đổi thành phần hóa học với nhau để tạo ra hợp chất mới. . Số oxi hóa của các nguyên tố trong phản ứng trao đổi không thay đổi.
2NH4NO3 + BaCl2 → 2NH4Cl + Ba(NO3)2
4. Bài tập gợi ý về tính chất hóa học của muối
Câu hỏi:
Nêu tính chất hóa học của muối ăn khi tác dụng với dung dịch chất khác để tạo thành:
- a) Khí;
- b) Kết tủa.
Viết phương trình hóa học.
Câu trả lời chi tiết:
- a) Dựa vào sơ đồ tính chất hóa học của muối, ta chọn muối sunfit hoặc muối cacbonat phản ứng với axit mạnh.
Ví dụ:
CaCO3 + HCl thành CaCl2 + CO2↑ + H2O
Na2SO3 + H2SO4 trở thành Na2SO4 + SO2↑ + H2O
Na2CO3 + 2HCl trở thành 2NaCl + CO2 + H2O
NaHCO3 + HCl thành NaCl + H2O + CO2
- b) Để luyện tập tính chất hóa học của muối, bạn chọn các muối không tan (BaSO4, BaCO3, AgCl,…) trong bảng độ tan của muối. Hoặc dựa vào tính chất hóa học của muối cacbonat, bạn có thể chọn bazơ không tan để tìm chất còn lại và muối tham gia phản ứng. Ví dụ tính chất hóa học của muối sắt 2:
BaCl2 + H2SO4 → 2HCl + BaSO4↓
Na2CO3 + Ba(NO3)2 → 2NaNO3 + BaCO3↓
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4↓
NaCl + AgNO3 → NaNO3 + AgCl
Hình 3: Bài tập hóa học của muối
5. Hướng dẫn pha muối đơn giản
- Cách trung hòa axit, bazơ: Để điều chế tính chất hóa học của muối silicat, phương pháp này cực kỳ phổ biến. Để tạo thành muối và nước, nó liên quan đến phản ứng của axit với bazơ. Ví dụ, để điều chế axit clohydric (HCl), muối natri clorua (NaCl) được trung hòa bằng natri hydroxit (NaOH) để tạo ra nước và NaCl.
- Cách trung hòa kiềm – axit: Áp dụng tính chất hóa học của muối là làm ngược lại với phương pháp trên. Trong đó, chất kiềm được sử dụng để trung hòa axit tạo thành nước và muối. Ví dụ, muối canxi clorua (CaCl2) có thể được điều chế bằng cách trung hòa axit clohydric (HCl) với canxi hydroxit (Ca(OH)2).
Trên đây là bài học về tính chất hóa học của muối mà các bạn có thể tham khảo và áp dụng kiến thức vào cuộc sống. Hy vọng bài viết đã giúp các bạn hiểu rõ hơn về khái niệm này cũng như phương pháp pha muối.



Nội dung được phát triển bởi đội ngũ Meraki Center với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@merakicenter.edu.vn